
Wetenschap
Hoe wordt een zwavelatoom ion?
Inzicht in de eigenschappen van zwavel
* Elektronenconfiguratie: Zwavel heeft 16 elektronen, met de volgende configuratie:2-8-6. Dit betekent dat het 6 elektronen heeft in zijn buitenste schaal (valentieschaal).
* octetregel: Atomen streven ernaar een volledige buitenste schaal van 8 elektronen (octet) te hebben. Dit maakt ze stabieler.
Een ion vormen
Zwavel kan op twee manieren een ion worden:
* elektronen verkrijgen (anion): De meest gebruikelijke manier voor zwavel om een ion te vormen, is door twee elektronen te winnen. Dit vult zijn buitenste schaal en bereikt de stabiele octetconfiguratie.
* Elektronen verliezen (kation): Het komt minder vaak voor, maar zwavel kan ook elektronen verliezen om een kation te vormen. Dit is minder waarschijnlijk omdat het veel energie vereist om de sterke aantrekkingskracht van de kern op zijn valentie -elektronen te overwinnen.
Het zwavelanion (S²⁻)
* proces: Zwavel krijgt twee elektronen om S²⁻ te worden. Dit komt omdat het verkrijgen van twee elektronen zijn buitenste schaal compleet maakt (2-8-8), en dus stabieler.
* opladen: De negatieve lading komt van de extra twee elektronen. Elk elektron heeft een negatieve lading en zwavel heeft nu twee meer dan zijn neutrale toestand.
Het zwavelkation (S⁴⁺, S⁶⁺)
* proces: In zeer specifieke situaties kan zwavel 4 of 6 elektronen verliezen om respectievelijk S⁴⁺ of S⁶⁺ te vormen. Deze ionen zijn zeer reactief en onstabiel.
Key Points
* ionenvorming: Het proces van een ion wordt ionisatie genoemd.
* stabiliteit: Ionvorming is bedoeld om een stabielere elektronenconfiguratie te bereiken (meestal een volledige buitenste schaal).
* ionische verbindingen: Ionen combineren vaak om ionische verbindingen te vormen. Zwavel vormt bijvoorbeeld meestal een ionische verbinding met metalen, zoals natriumsulfide (NA₂S).
Laat het me weten als je op een van deze punten meer details wilt!
 Wat is de vereiste dat een molecuul UV actief is?
Wat is de vereiste dat een molecuul UV actief is?  Stabiliserende 2-D gelaagde perovskieten voor fotovoltaïsche zonne-energie:een verdedigingsmuur opzetten
Stabiliserende 2-D gelaagde perovskieten voor fotovoltaïsche zonne-energie:een verdedigingsmuur opzetten Hoeveel mol in 55 g lithiumchloride?
Hoeveel mol in 55 g lithiumchloride?  Een student verdunde zorgvuldig 25,0 ml 0,6 M NaOH-oplossing in 475 ml gedestilleerd water. Wat is de molariteitsbase?
Een student verdunde zorgvuldig 25,0 ml 0,6 M NaOH-oplossing in 475 ml gedestilleerd water. Wat is de molariteitsbase?  Wat te gebruiken Verwijder roest van metaal?
Wat te gebruiken Verwijder roest van metaal?
 Overstromingsgevoelig Miami om miljarden uit te geven om zeespiegelstijging aan te pakken
Overstromingsgevoelig Miami om miljarden uit te geven om zeespiegelstijging aan te pakken De 20e eeuw was de heetste in bijna 2, 000 jaar, onderzoeken tonen aan
De 20e eeuw was de heetste in bijna 2, 000 jaar, onderzoeken tonen aan IJzercarbonaten in de aardmantel helpen bij het vormen van diamanten
IJzercarbonaten in de aardmantel helpen bij het vormen van diamanten Sidewinder Snake Facts
Sidewinder Snake Facts Ongewenste verandering van de zee:uit nieuw onderzoek blijkt dat overstromingen langs de kust tegen 2100 tot 20% van de wereldeconomie kunnen kosten
Ongewenste verandering van de zee:uit nieuw onderzoek blijkt dat overstromingen langs de kust tegen 2100 tot 20% van de wereldeconomie kunnen kosten
Hoofdlijnen
- Welke van deze orgelsystemen vereist het minst het zenuwstelsel om te functioneren?
- Stadsuitbreiding in Perth die het seksleven van planten beïnvloedt
- Nieuw model suggereert hoe de hersenen in balans kunnen blijven
- Alle levende organismen beginnen met de afbraak van hun voedsel door?
- Hoe vampieren werken
- Nieuwe hypothese:waarom bacteriën steeds resistenter worden tegen antibiotica
- Hoe een 'antibioticum' bacteriën helpt eten
- Hoe verschillen celdifferentiatie en vastberadenheid?
- Welke twee soorten planten hebben bacteriën ontbinden in hun wortels?
- Onderzoekers ontwikkelen een toxinevrij lijmsysteem geïnspireerd op onderwaterwezens

- Dun, rekbare biosensoren kunnen chirurgie veiliger maken
- Brandstof van afgedankte banden

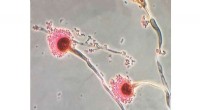
- Chemici kenmerken de dodelijke schimmel onder ons
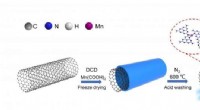
- Mangaan single-atom katalysator verhoogt de prestaties van elektrochemische kooldioxide-reductie
 Kneuzingen Qualcomm-Broadcom strijden voor confrontatie
Kneuzingen Qualcomm-Broadcom strijden voor confrontatie Weefselfase-sorptie-extractie voor goedkopere, sneller, en meer gevoelige biologische en milieubemonstering
Weefselfase-sorptie-extractie voor goedkopere, sneller, en meer gevoelige biologische en milieubemonstering Coronavirus escaleerde gewapende conflicten in verschillende door oorlog verscheurde landen
Coronavirus escaleerde gewapende conflicten in verschillende door oorlog verscheurde landen Hoe de uitvinding van de microscoop wetenschappers hielp cellen te begrijpen?
Hoe de uitvinding van de microscoop wetenschappers hielp cellen te begrijpen?  Hoe wordt de doorgang van energie door iets genoemd?
Hoe wordt de doorgang van energie door iets genoemd?  NASA geeft groen licht voor de eerste bemande SpaceX-vlucht op 27 mei
NASA geeft groen licht voor de eerste bemande SpaceX-vlucht op 27 mei Vertrouwen Chinese investeerders uitgebreide auditrapporten?
Vertrouwen Chinese investeerders uitgebreide auditrapporten?  Maak een lijst van alle niet -levende wezens in woestijn?
Maak een lijst van alle niet -levende wezens in woestijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

