
Wetenschap
Wat is de formule voor samengestelde disulfur pentachloride?
Dit is waarom:
* zwavel en chloor vormen verschillende verbindingen. De meest voorkomende verbindingen gevormd door zwavel en chloor zijn zwaveldichloride (SCL₂) en zwaveltetrachloride (SCL₄).
* "Disulfur" suggereert twee zwavelatomen. In de typische verbindingen gevormd met zwavel en chloor is er echter slechts één zwavelatoom per molecuul.
Mogelijke verkeerde interpretaties:
* disulfur dichloride (s₂cl₂): Deze verbinding bestaat en wordt soms "zwavelmonochloride" genoemd (niet te verwarren met zwavelmonochloride, een andere verbinding).
* zwavel pentachloride (SCL₅): Deze verbinding bestaat niet in stabiele vorm. Zwavel kan slechts maximaal vier bindingen vormen vanwege de elektronenconfiguratie.
samenvatten: Hoewel "disulfur pentachloride" misschien een geldige formule lijkt, komt het niet overeen met een bekende stabiele chemische verbinding.
 Welk gas te gebruiken voor het snijden van plasma?
Welk gas te gebruiken voor het snijden van plasma?  Waarom zijn koolstof en waterstof in de reactiviteitsreeks?
Waarom zijn koolstof en waterstof in de reactiviteitsreeks?  Een munt van 6,80 g wordt opgelost in salpeterzuur en 6,21 g AgCl wordt neergeslagen door de toevoeging van een overmaat natriumchloride. Bereken het percentage zilveren munt?
Een munt van 6,80 g wordt opgelost in salpeterzuur en 6,21 g AgCl wordt neergeslagen door de toevoeging van een overmaat natriumchloride. Bereken het percentage zilveren munt?  Nanoshell-katalysatoren zetten broeikasgassen om in nuttige chemicaliën
Nanoshell-katalysatoren zetten broeikasgassen om in nuttige chemicaliën Wat is de enkele verplaatsingsreactie van Mg plus H2CO3?
Wat is de enkele verplaatsingsreactie van Mg plus H2CO3?
 Hoe heeft de geografie van Amerika gevolgen voor vroege mensen op zoek naar voedsel?
Hoe heeft de geografie van Amerika gevolgen voor vroege mensen op zoek naar voedsel?  Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie
Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie Hoe getijden het grondwater onder onze voeten beïnvloeden
Hoe getijden het grondwater onder onze voeten beïnvloeden De verschillende soorten dieren en planten op Ben Nevis?
De verschillende soorten dieren en planten op Ben Nevis?  Zware metalen in slangenlevers geven aanleiding tot bezorgdheid over het milieu
Zware metalen in slangenlevers geven aanleiding tot bezorgdheid over het milieu
Hoofdlijnen
- Hoe roodwangindringers de inheemse schildpadden in Californië schade toebrengen
- Waarom produceert het lichaam meer weefsel?
- Hoe de neus van een baby de geur van mama kent
- Wat is de medische term die compressie van omliggende cellen betekent door tumorcellen?
- Welke levende wezens zijn volledig samengesteld uit een cel?
- Wat zijn de verschillende eigenschappen die wetenschapper over het algemeen bezit?
- Wat is een voorbeeld van postzygotische isolatie?
- Wat bevat een erfelijke informatie.
- Slapen spinnen? Uit onderzoek blijkt dat ze net als mensen kunnen dutten
- Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders
- Studie identificeert meest veelbelovende grondstoffen voor op pyrolyse gebaseerde bioraffinage

- Onderzoekers patenteren snelle tests voor cocaïne

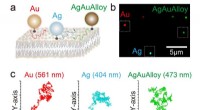
- Snelle en nauwkeurige meerkleurenbeeldvorming van biomoleculen nu mogelijk
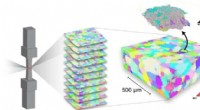
- 3D-experimenten werpen nieuw licht op legeringen met vormgeheugen
 Hoe lang duurt het voordat kunststoffen biologisch worden afgebroken?
Hoe lang duurt het voordat kunststoffen biologisch worden afgebroken?  NASA InSight-team op koers voor landing op Mars
NASA InSight-team op koers voor landing op Mars Selectieve concentratie van kationische soorten
Selectieve concentratie van kationische soorten Verbetering van de magnetoweerstandsverhouding in op Heusler gebaseerde legering
Verbetering van de magnetoweerstandsverhouding in op Heusler gebaseerde legering Hoe komt het dat de nieuwe maan altijd de eerste dag van de maand?
Hoe komt het dat de nieuwe maan altijd de eerste dag van de maand?  Wat is de relatieve afstand van kwik en zon?
Wat is de relatieve afstand van kwik en zon?  Bij het injecteren van pure spin in chirale materialen is richting van belang
Bij het injecteren van pure spin in chirale materialen is richting van belang  Wat is het moleculaire model voor HOCN?
Wat is het moleculaire model voor HOCN?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

