
Wetenschap
Wat is de chemische reactie van CUCL2 en aluminium?
3CUCl₂ (aq) + 2al (s) → 2alcl₃ (aq) + 3Cu (s)
Verklaring:
* reactanten:
* Cucl₂ (koper (II) chloride) is een waterige oplossing, wat betekent dat deze in water is opgelost.
* AL (aluminium) is een massief metaal.
* Producten:
* Alcl₃ (aluminiumchloride) is een waterige oplossing.
* Cu (koper) is een massief metaal.
Wat gebeurt er:
* Aluminium is reactiever dan koper. Dit betekent dat het een sterkere neiging heeft om elektronen te verliezen en positieve ionen te vormen.
* Wanneer aluminium in contact komt met koper (II) chloride, verplaatsen de aluminiumatomen de koperionen uit de oplossing.
* Aluminium vormt aluminiumchloride (alcl₃), die oplost in water.
* Kopermetaal (Cu) wordt afgezet als een vaste stof.
Observaties:
* Je zult een roodbruine vaste (koper) zien die vormt op het oppervlak van het aluminium.
* De oplossing zal van kleur veranderen als het koper (II) chloride wordt verbruikt.
belangrijke opmerkingen:
* Deze reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* De reactie kan behoorlijk krachtig zijn, vooral als het aluminium in poedervorm is.
* Deze reactie wordt in sommige toepassingen gebruikt om koper te zuiveren.
Laat het me weten als je meer wilt verkennen over een van deze punten!
 Wat is het smeltpunt van gedestilleerd water?
Wat is het smeltpunt van gedestilleerd water?  Een neutralisatiereactie tussen een zuur en een metaalhydroxide produceert?
Een neutralisatiereactie tussen een zuur en een metaalhydroxide produceert?  Waarom neemt de oplosbaarheid van lithiumcarbonaat af naarmate de temperatuur stijgt?
Waarom neemt de oplosbaarheid van lithiumcarbonaat af naarmate de temperatuur stijgt?  Wat zijn de term voornmaterialen met een zeer lage thermische energie en weerstand?
Wat zijn de term voornmaterialen met een zeer lage thermische energie en weerstand?  Welk element heeft een atoomnummer dat een groter is dan platina?
Welk element heeft een atoomnummer dat een groter is dan platina?
 Welke omgevingsfactoren kunnen de grootte van bladeren op een boom beïnvloeden?
Welke omgevingsfactoren kunnen de grootte van bladeren op een boom beïnvloeden?  De tevredenen zullen de aarde erven. De sombere? Niet zo veel
De tevredenen zullen de aarde erven. De sombere? Niet zo veel  Statistieken plot vervuiling om het beleid te informeren
Statistieken plot vervuiling om het beleid te informeren Onderzoekers meten koolstofvoetafdruk van waterkrachtcentrales in Canada
Onderzoekers meten koolstofvoetafdruk van waterkrachtcentrales in Canada Het weer belemmert de inspanningen om de Indonesische tsunami-vulkaan te inspecteren
Het weer belemmert de inspanningen om de Indonesische tsunami-vulkaan te inspecteren
Hoofdlijnen
- Model analyseert hoe virussen aan het immuunsysteem ontsnappen
- Wat is de functie van een celwand?
- Wat is genshuffling?
- Hoe een beter begrip van het gedrag van hermelijnen de bestrijding van roofdieren in Aotearoa zal helpen
- Wat is het embryo -embryo van zaadspoornissen of een jonge plant?
- Welk Genotype zijn vrouwen?
- Onderzoekers:Desinformatiecampagnes ondermijnen de democratie – zo kunnen we terugvechten
- Een smakelijke wat trekt hongerige dieren aan die de plant kunnen helpen zijn zaden te verspreiden?
- Wat is de functie van spicula?
- Zichtbaar licht-geïnduceerde bifunctionele rhodium katalyse ontwikkeld voor decarbonylatieve koppeling van imiden met alkynen
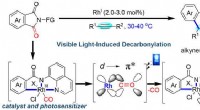
- Katalysatoren gevonden om koolstofdioxide om te zetten in brandstof

- Lab-gekweekte pigmenten en voedselbijproducten:de toekomst van natuurlijke textielkleurstoffen

- Neutronen vangen vormveranderend coronavirus-eiwitcomplex op heterdaad
- Onderzoeksteam vindt licht de sleutel tot veelbelovend materiaal

 Wat verandert altijd de snelheid van een object?
Wat verandert altijd de snelheid van een object?  Hoeveel verschillende energieën zijn er?
Hoeveel verschillende energieën zijn er?  Wat is de verste plant uit de zon?
Wat is de verste plant uit de zon?  Gibbs vrije energievergelijking gebruiken Wat is de verandering voor de synthese van koolstofdisulfide bij 25C?
Gibbs vrije energievergelijking gebruiken Wat is de verandering voor de synthese van koolstofdisulfide bij 25C?  Hoeveel niet -gepaarde elektronen zijn er in een zwavelatoom (atoomnummer 16)?
Hoeveel niet -gepaarde elektronen zijn er in een zwavelatoom (atoomnummer 16)?  Hoe worden magneten in speelgoed gebruikt?
Hoe worden magneten in speelgoed gebruikt?  Wat is de frequentie van een golf met periode 0.125?
Wat is de frequentie van een golf met periode 0.125?  Team ontwikkelt milieuvriendelijke, vlamvertragend koolstofplastic, ideaal voor recycling
Team ontwikkelt milieuvriendelijke, vlamvertragend koolstofplastic, ideaal voor recycling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

