
Wetenschap
Hoe wordt het ion van zwavel gevormd?
* Sulphur's Electron Configuration: Zwavel (en) heeft 16 elektronen, met de elektronenconfiguratie:2, 8, 6. Dit betekent dat het 6 elektronen in zijn buitenste schaal (valentieschaal) heeft.
* stabiliteit: Atomen zijn meestal het meest stabiel wanneer ze een volledige buitenste schaal hebben, zoals de edelgassen. Voor zwavel betekent dit dat 8 elektronen in zijn valentieschaal hebben.
* Elektronen verkrijgen: Om stabiliteit te bereiken, kan zwavel 2 elektronen krijgen. Dit vult zijn valentieschaal en geeft het een stabiele elektronenconfiguratie zoals Argon (2, 8, 8).
* Vorming van het sulfide -ion: Door 2 elektronen te winnen, wordt zwavel negatief geladen, waardoor het sulfide-ion wordt gevormd (S
2-
).
Samenvattend:
* Zwavel heeft 6 valentie -elektronen.
* Het krijgt 2 elektronen om een stabiel octet te bereiken.
* Dit resulteert in de vorming van het sulfide-ion (S
2-
).
 Wat geeft het atoomnummer weer?
Wat geeft het atoomnummer weer?  Waarom groeien boraxkristallen anders bij verschillende temperaturen?
Waarom groeien boraxkristallen anders bij verschillende temperaturen?  Waarom lossen hydrofobe stoffen op in water?
Waarom lossen hydrofobe stoffen op in water?  Een pycnocline is een grens tussen veranderende regio's waarvan de volgende eigenschappen?
Een pycnocline is een grens tussen veranderende regio's waarvan de volgende eigenschappen?  Welke atomen hebben dezelfde chemische eigenschappen als die van calcium?
Welke atomen hebben dezelfde chemische eigenschappen als die van calcium?
 Welke symbiotische levensvormen kunnen op stenen groeien en helpen bij de vorming van de grond?
Welke symbiotische levensvormen kunnen op stenen groeien en helpen bij de vorming van de grond?  Warmtevasthoudende kooldioxidegehaltes in de lucht bereiken opnieuw een hoogtepunt
Warmtevasthoudende kooldioxidegehaltes in de lucht bereiken opnieuw een hoogtepunt Twee luchtmassa's die een tornado veroorzaken
Twee luchtmassa's die een tornado veroorzaken Homemade Apple Deer Licks
Homemade Apple Deer Licks  Waarom is erosie een belangrijk natuurlijk proces?
Waarom is erosie een belangrijk natuurlijk proces?
Hoofdlijnen
- Wat is de classificatie van een Colorado -kever?
- Wanneer dupliceren chromosomen tijdens een cellevenscyclus?
- Is een organisme geclassificeerd als persoon?
- Nieuwe studie onderzoekt hoe het dengue-virus het gedrag van muggen verandert
- Wat zorgt ervoor dat zaadkieming begint?
- Wat zijn de eiwitten ingebed in lipide dubbellaag?
- Hoe de menselijke bevolking voortkwam uit ons vermogen om samen te werken
- Wat is de erfgenaam van materie?
- Er is een genetische reden waarom Labrador Retrievers geobsedeerd zijn door voedsel
- Deze hydrogeltablet kan een liter rivierwater in een uur zuiveren

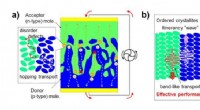
- Ladingsdragers volgen in het moleculaire kristal op organische pn-junctie
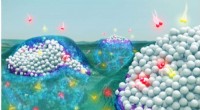
- Mysterieus organisch uitschot verhoogt de efficiëntie van chemische reacties, kan chemisch afval verminderen
- Kunstmatige cellen-in-cellen die door licht worden geactiveerd, fungeren als mini-chemische reactoren

- Onderzoekers vinden een betere manier om metaallegeringen te ontwerpen

 Wetenschappers onthullen het mysterie over de oorsprong van goud
Wetenschappers onthullen het mysterie over de oorsprong van goud wat is een ecosysteem?
wat is een ecosysteem?  Volgende vier Galileo-satellieten klaar voor lancering
Volgende vier Galileo-satellieten klaar voor lancering Robots kunnen helemaal naar Mars gaan, maar ze kunnen de boodschappen niet ophalen
Robots kunnen helemaal naar Mars gaan, maar ze kunnen de boodschappen niet ophalen Welk type energie gaat verloren in de magnetron?
Welk type energie gaat verloren in de magnetron?  Hoe inefficiënties op de aandelenmarkten de reële economie kunnen beïnvloeden
Hoe inefficiënties op de aandelenmarkten de reële economie kunnen beïnvloeden Zwaartekrachtwendingen helpen theoretische natuurkundigen licht te werpen op kwantumcomplexiteit
Zwaartekrachtwendingen helpen theoretische natuurkundigen licht te werpen op kwantumcomplexiteit Nieuw onderzoek naar Darwins vinken biedt een zeldzaam inzicht in hoe soorten uiteenlopen
Nieuw onderzoek naar Darwins vinken biedt een zeldzaam inzicht in hoe soorten uiteenlopen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

