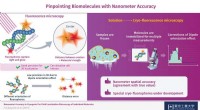
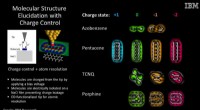
Wetenschap
Waarom reageert benzylchloride sneller dan 1-clorobutaan wanneer het wordt behandeld met natriumjodide in aceton?
1. Stabiliteit van de carbocatie:
* benzylchloride vormt een gestabiliseerde benzylische carbocatie Tijdens de SN2 -reactie. Deze carbocatie is resonantie gestabiliseerd door de delocalisatie van de positieve lading in de benzeenring. Deze stabilisatie maakt de vorming van de carbocatie gunstiger, waardoor de reactiesnelheid toeneemt.
* 1-chloorobutane vormt een primaire carbocatie die minder stabiel is en minder snel zal worden gevormd.
2. Sterische hindering:
* benzylchloride heeft minder sterische hindering rond de koolstof die het chlooratoom draagt in vergelijking met 1-chloorobutane . Dit maakt het gemakkelijker voor het jodide -ion om het koolstofatoom in benzylchloride aan te vallen, wat leidt tot een snellere reactie.
* 1-chloorobutane Heeft meer sterische belemmering rond de koolstof die het chlooratoom draagt, waardoor het voor het jodide -ion moeilijker wordt om aan te vallen.
3. Polariseerbaarheid van de Leaving Group:
* Het chloride -ion In beide gevallen is een goede vertragingsgroep, maar de polariseerbaarheid van het halogenide -ion speelt ook een rol.
* Jodide -ion is meer polariseerbaar dan chloride -ion, waardoor het een betere nucleofiel is en bijdraagt aan de snellere reactiesnelheid met benzylchloride.
Samenvattend:
* stabilisatie van de carbocatie: Benzylchloride vormt een stabielere carbocatie.
* sterische hindering: Benzylchloride heeft minder sterische hindering.
* Polariseerbaarheid van de Leaving Group: Jodide -ion is een betere nucleofiel.
Al deze factoren dragen bij aan de snellere reactiesnelheid van benzylchloride vergeleken met 1-chloorobutaan wanneer het wordt behandeld met natriumjodide in aceton.
 Hoe kan de oplosbaarheid worden beïnvloed?
Hoe kan de oplosbaarheid worden beïnvloed?  Product van een grondige vermenging van twee of meer stoffen die niet chemisch worden gecombineerd?
Product van een grondige vermenging van twee of meer stoffen die niet chemisch worden gecombineerd?  Wat is de Lewis Dot -structuur voor natriumhydroxide?
Wat is de Lewis Dot -structuur voor natriumhydroxide?  Welke verandering van het oppervlak wanneer vers gesneden lithiummetaal reageert met lucht?
Welke verandering van het oppervlak wanneer vers gesneden lithiummetaal reageert met lucht?  Wat beschrijft de beweging van watermolecuul in ijs?
Wat beschrijft de beweging van watermolecuul in ijs?
 KAN WETENSCHAPPER DEZELFDE PRINCIPES GEBRUIKEN OM DE GESCHIEDENIS VAN DE AARDE TE BESTUDEREN?
KAN WETENSCHAPPER DEZELFDE PRINCIPES GEBRUIKEN OM DE GESCHIEDENIS VAN DE AARDE TE BESTUDEREN?  Hoe boomdiversiteit binnendringend bosongedierte reguleert
Hoe boomdiversiteit binnendringend bosongedierte reguleert  Heeft orkaan Barry een bijna-record dode zone voorkomen?
Heeft orkaan Barry een bijna-record dode zone voorkomen? Magma modelleren om koper te vinden
Magma modelleren om koper te vinden Consumenten zijn bereid te betalen voor ecosysteemdiensten
Consumenten zijn bereid te betalen voor ecosysteemdiensten
Hoofdlijnen
- Vertakking voor voedsel:hoe voedingsstoffen de bloedsomloop van vliegen hervormen
- Wanneer moet u uw hond castreren of steriliseren? Onderzoekers actualiseren richtlijnen
- Wat is mager tissue?
- Type energie geproduceerd door fotosynthese
- Wat maakt Bones moeilijk?
- Wat zijn de eerste en tweede wetten van de thermodynamica die ze in biologische systemen verklaren?
- Wat is een voorbeeld van een virus dat bolvormig is?
- Wat is de naam van een wetenschapper die water en cyclus bestudeert?
- Bevindingen suggereren hoe zwemmende cellen biofilms vormen op oppervlakken
 Nieuwe strategie stimuleert directe elektrolyse van verdunde kooldioxide
Nieuwe strategie stimuleert directe elektrolyse van verdunde kooldioxide  Wat is de hoeveelheid energie -aerobe systeem die in staat is om elke minuut het beste te produceren dat het best wordt geschat door?
Wat is de hoeveelheid energie -aerobe systeem die in staat is om elke minuut het beste te produceren dat het best wordt geschat door?  In termen van energietransfers en transformaties, hoe wordt geluid verzonden telefonisch ontvangen?
In termen van energietransfers en transformaties, hoe wordt geluid verzonden telefonisch ontvangen?  Wat zijn de kenmerken van berggrond?
Wat zijn de kenmerken van berggrond?  Geautomatiseerde biologie, of hoe je een populatie cellen kunt besturen met een computer
Geautomatiseerde biologie, of hoe je een populatie cellen kunt besturen met een computer Wat zijn de kenmerken van de hemel?
Wat zijn de kenmerken van de hemel?  Fabrieksmedewerker Boeing test positief op virus
Fabrieksmedewerker Boeing test positief op virus Wat is de National Reclamation Act uit 1902?
Wat is de National Reclamation Act uit 1902?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com