
Wetenschap
Hoeveel gram zwavelzuur is nodig om te reageren met 8 mol ammoniumhydroxide?
1. Evenwichtige chemische vergelijking
De reactie tussen zwavelzuur (H₂so₄) en ammoniumhydroxide (NH₄OH) is:
H₂so₄ + 2nh₄oh → (NH₄) ₂SO₄ + 2H₂O
2. Mol Ratio
De gebalanceerde vergelijking toont aan dat 1 mol zwavelzuur reageert met 2 mol ammoniumhydroxide.
3. Bereken mol zwavelzuur
Omdat we 8 mol ammoniumhydroxide hebben, hebben we de helft van die hoeveelheid zwavelzuur nodig:
8 mol nh₄oh * (1 mol H₂so₄ / 2 mol nh₄oh) =4 mol H₂so₄
4. Converteer mollen naar grams
De molaire massa van zwavelzuur (H₂so₄) is ongeveer 98 g/mol.
4 mol H₂so₄ * (98 g/mol) = 392 g h₂so₄
Daarom heb je 392 gram zwavelzuur nodig om te reageren met 8 mol ammoniumhydroxide.
 Reageren basen met metalen en produceren ze waterstofgas?
Reageren basen met metalen en produceren ze waterstofgas?  Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat
Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat Nieuw materiaal voor katholieten en anolieten in organische redoxflow-batterijen
Nieuw materiaal voor katholieten en anolieten in organische redoxflow-batterijen Hematiet kan zich vormen als gevolg van de procesoxidatie?
Hematiet kan zich vormen als gevolg van de procesoxidatie?  Waarom is het smeltpunt van p-chloorfenol hoger dan dat van o-chloorfenol?
Waarom is het smeltpunt van p-chloorfenol hoger dan dat van o-chloorfenol?
 Om kusteigendom te redden van stijgende zeeën, we hebben gezamenlijke planning nodig
Om kusteigendom te redden van stijgende zeeën, we hebben gezamenlijke planning nodig Hoe de Azteken de moderne stadslandbouw konden verbeteren
Hoe de Azteken de moderne stadslandbouw konden verbeteren  Wat is de kracht van aantrekkingskracht die bestaat tussen twee objecten?
Wat is de kracht van aantrekkingskracht die bestaat tussen twee objecten?  Acacia is een voorbeeld van monocotyledon of dicotyledon?
Acacia is een voorbeeld van monocotyledon of dicotyledon?  Zeldzame kleuren voor het menselijk oog
Zeldzame kleuren voor het menselijk oog
Hoofdlijnen
- Wat voor soort bacteriën breekt dode organismen af?
- Wat is een fossiel?
- Nieuw model helpt verklaren hoe voorzieningen ziekten in het wild bevorderen of verminderen
- Hoe adaptieve veranderingen in cellulaire vloeistoffen het leven in zee in staat stellen om te gaan met abiotische stressoren
- Wat zijn de speciale kenmerken van collenchymcellen?
- Dat geldt voor unipotente stamcellen A. Ze kunnen alleen produceren die zoals zij zijn. B. Ze gevonden bij dieren op lage trofische niveaus. C. hebben ze geen organellen ingesloten membr?
- Wie zijn de Forienger Scientist?
- Ware of valse vacuolen zijn de krachtpatsers van cellen?
- Waar zijn de DNA -bases aan gekoppeld?
- Kunststoffen zijn niet wat we denken. Nieuwe studie vindt dat ze een beetje rubberachtig zijn, de weg vrijmaken voor betere producten

- Verbeterde osteogene activiteit van pre-osteoblasten op aan het oppervlak gemodificeerde 3D-geprinte steigers

- Nieuwe test biedt nauwkeurige meting van DNA-schade door chemische verbindingen

- Wetenschappers schakelen bakkersgist in op jacht naar nieuwe medicijnen
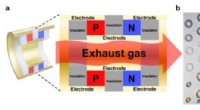
- Een thermo-elektrische inkt die uitlaatpijpen van auto's verandert in stroomgeneratoren
 Hoe berekent u de versnelling in de ruimte?
Hoe berekent u de versnelling in de ruimte?  Vertel de twee soorten wetenschap?
Vertel de twee soorten wetenschap?  Wat is een gedicht voor helium?
Wat is een gedicht voor helium?  Hoe zijn zowel Uranus als Neptunus?
Hoe zijn zowel Uranus als Neptunus?  Waarom worden bladeren op een boom in de lente groen van boven naar beneden?
Waarom worden bladeren op een boom in de lente groen van boven naar beneden?  Waar trekt de zwaartekracht tektonische spelen?
Waar trekt de zwaartekracht tektonische spelen?  Eerste vluchten voor CO2-detecterende lidar
Eerste vluchten voor CO2-detecterende lidar Hoe vind je de omvang van het eerste momentum?
Hoe vind je de omvang van het eerste momentum?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

