
Wetenschap
Wat zou er worden gevormd bij de kathode en anode tijdens elektrolyse van natriumhydroxide -oplossing?
elektrolyse van natriumhydroxide -oplossing
* elektrolyt: Waterige oplossing van NaOH (natriumhydroxide). Deze oplossing bevat Na+ ionen, OH-ionen en watermoleculen.
* elektroden: Gewoonlijk worden inerte elektroden zoals platina of nikkel gebruikt om ongewenste reacties te voorkomen.
reacties op de elektroden
* kathode (negatieve elektrode):
* Primaire reactie: Watermoleculen krijgen elektronen en worden gereduceerd tot waterstofgas en hydroxide -ionen:
2h₂o + 2e⁻ → H₂ (g) + 2OH⁻
* Reden: Waterstofionen (H+) zijn veel minder overvloedig in een basisoplossing, waardoor de vermindering van water gunstiger wordt.
* anode (positieve elektrode):
* Primaire reactie: Hydroxide -ionen verliezen elektronen en worden geoxideerd tot zuurstofgas en water:
4OH⁻ → O₂ (G) + 2H₂O + 4E⁻
* Reden: De oxidatie van hydroxide -ionen is gunstiger dan de oxidatie van water.
Samenvatting van producten
* kathode: Waterstofgas (H₂) wordt geproduceerd.
* anode: Zuurstofgas (O₂) wordt geproduceerd.
Belangrijke opmerking: De concentratie van NaOH kan enigszins toenemen bij de kathode vanwege de vorming van extra hydroxide -ionen. De algehele samenstelling van de oplossing blijft echter grotendeels hetzelfde.
Laat het me weten als je een meer gedetailleerde uitleg wilt van de elektrochemische principes achter dit proces!
 Tips voor het onthouden van sterke zuren en basen
Tips voor het onthouden van sterke zuren en basen  Een kaart van reacties helpt bij het controleren van moleculaire eigenschappen
Een kaart van reacties helpt bij het controleren van moleculaire eigenschappen Wat is opgeloste zuiverheid?
Wat is opgeloste zuiverheid?  Als we kalium nikkel en ijzer combineren, welk wapen wordt er gevormd?
Als we kalium nikkel en ijzer combineren, welk wapen wordt er gevormd?  AI-aangedreven microscoop kan binnen enkele minuten kankermarges controleren
AI-aangedreven microscoop kan binnen enkele minuten kankermarges controleren
 Noord-Zuid-kloof in de wetenschap kan maatregelen tegen klimaatverandering belemmeren
Noord-Zuid-kloof in de wetenschap kan maatregelen tegen klimaatverandering belemmeren NASA-satelliet ziet Typhoon Noru in infrarood licht
NASA-satelliet ziet Typhoon Noru in infrarood licht Rol van beton bij het verminderen van emissies van gebouwen en bestrating
Rol van beton bij het verminderen van emissies van gebouwen en bestrating Fluorkoolwaterstoffen redden de ozonlaag, dus waarom verbieden we ze?
Fluorkoolwaterstoffen redden de ozonlaag, dus waarom verbieden we ze? Plastic in zee kost de samenleving miljarden dollars
Plastic in zee kost de samenleving miljarden dollars
Hoofdlijnen
- Begrijpen hoe autoactivatie celdood veroorzaakt
- Nepal op schema om doel van verdubbeling tijgerpopulatie tegen 2022 te halen
- Wat is een flexibele structuur die cel bij elkaar houdt?
- Hoe zijn Euglenas vergelijkbaar met dierlijke zooflagellaten?
- Waarom gebruiken wetenschappers verschillende methoden bij het onderzoeken van wetenschap?
- Kiemcellen bewegen als kleine bulldozers
- Wat is Embryo Cloning?
- Wat zijn drie vormen van monosachariden?
- Welke vorm vormt de meeste plasmamembraancellen?
- Onderzoekers ontdekken nieuwe strategie voor ontwikkeling van mensgeïntegreerde elektronica

- Nieuwe zenuwgasdetector gebouwd met lego's en een smartphone

- Nieuwe techniek om temperaturen in verbrandingsvlammen te meten kan leiden tot schonere biobrandstoffen

- Poreuze kristallen gebruiken om licht te oogsten
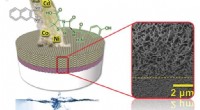
- Nieuw, op waterbasis, recyclebare membraanfilters alle soorten nanodeeltjes
 Wanneer is de versnelling van een lichaam positief?
Wanneer is de versnelling van een lichaam positief?  Hoe treden convectinale stromingen op in de mantel?
Hoe treden convectinale stromingen op in de mantel?  Wat is groter 44 L of 44000 ml?
Wat is groter 44 L of 44000 ml?  Het mengen van silicium met andere materialen verbetert de diversiteit van elektronische apparaten op nanoschaal
Het mengen van silicium met andere materialen verbetert de diversiteit van elektronische apparaten op nanoschaal Hoe zijn Jupiter en de zon vergelijkbaar?
Hoe zijn Jupiter en de zon vergelijkbaar?  Wanneer de snelheid van het lichaam dat in een rechte lijn beweegt continu verandert, verwerft dan?
Wanneer de snelheid van het lichaam dat in een rechte lijn beweegt continu verandert, verwerft dan?  Wat is een Marcoburst?
Wat is een Marcoburst?  Hoe ver zijn kometen naar de zon?
Hoe ver zijn kometen naar de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

