
Wetenschap
Welke reacties produceert ammoniumchloride en water?
Hier is de chemische vergelijking:
NH₄CL (S) + H₂o (L) → NH₄⁺ (aq) + Cl⁻ (aq)
Deze reactie is endotherm , wat betekent dat het warmte van de omgeving absorbeert. Als gevolg hiervan wordt de oplossing koeler dan het originele water.
Verklaring:
* Ammoniumchloride is een zout gevormd uit de reactie van een zwakke basis (ammoniak, NH₃) en een sterk zuur (zoutzuur, HCL).
* In water dissocieert ammoniumchloride in zijn samenstellende ionen, ammonium (NH₄⁺) en chloride (CL⁻).
* Ammoniumionen kunnen verder reageren met watermoleculen in een omkeerbaar evenwicht om hydroniumionen (h₃o⁺) te produceren en ammoniak (NH₃) . Deze reactie maakt de oplossing enigszins zuur vanwege de aanwezigheid van hydroniumionen.
Over het algemeen resulteert de reactie van ammoniumchloride en water in een enigszins zure oplossing, een afname van de temperatuur en de vorming van ammoniumionen, chloride -ionen en een kleine hoeveelheid hydroniumionen.
Hoofdlijnen
- Wat is osmose actief of passief?
- Waar komt ureum voornamelijk geconcentreerd?
- Wat is plantenmetabolisme?
- Verschil tussen koppelingstoewijzing en chromosoommapping
- Waar bevinden zich de mitochondriën in de dierlijke cel?
- Waarom is celvertaling nodig?
- Wat is een ecosysteem en vermeld het biotische abiotische deel ervan?
- Wat zijn de functies van microfilamenten en microtubuli?
- Wat zijn enkele voorbeelden van organismen?
- GLUT5 fluorescerende sonde vingerafdrukken kankercellen
- Onderzoeksteam vindt licht de sleutel tot veelbelovend materiaal

- Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken

- Nieuwe klasse zachte halfgeleiders kan HD-schermen transformeren
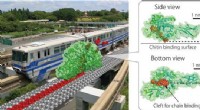
- Chitinase als verbrande brug Brownse monorail die op efficiënte wijze recalcitrante biomassa hydrolyseert
 Beelden verborgen in ruis onthuld door een op kwantum geïnspireerde fase-imaging-methode
Beelden verborgen in ruis onthuld door een op kwantum geïnspireerde fase-imaging-methode  Kan ik met een mens praten? Spanje presenteert rekening voor klantenservice
Kan ik met een mens praten? Spanje presenteert rekening voor klantenservice Wat is Amber en waarom het belangrijk is voor de wetenschap?
Wat is Amber en waarom het belangrijk is voor de wetenschap?  Hoe een Fox
Hoe een Fox Beroven planeten hun sterren van metalen?
Beroven planeten hun sterren van metalen?  Waarom is de interne hitte van de aarde zo belangrijk?
Waarom is de interne hitte van de aarde zo belangrijk?  Kun je van een auto een broedmachine maken?
Kun je van een auto een broedmachine maken?  Hoe verhoudt de zon zich met de gemiddelde ster?
Hoe verhoudt de zon zich met de gemiddelde ster?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


