
Wetenschap
Wat zijn de eigenschappen van koolwaterstof?
eigenschappen van koolwaterstoffen:
Koolwaterstoffen zijn organische verbindingen die uitsluitend zijn samengesteld uit koolstof (C) en waterstof (H) atomen. Hun eigenschappen variëren sterk, afhankelijk van de opstelling van deze atomen, specifiek:
1. Structuur en binding:
* kettinglengte: Koolwaterstoffen kunnen rechte, vertakte of cyclische ketens hebben. Langere ketens hebben hogere smelt- en kookpunten als gevolg van verhoogde intermoleculaire krachten.
* Verzadiging: Koolwaterstoffen kunnen verzadigd zijn (alkanen) of onverzadigd (alkenen, alkynes). Alkanen hebben enkele bindingen tussen koolstofatomen, terwijl alkenen dubbele bindingen hebben en alkynes drievoudige bindingen hebben. Onverzadiging verhoogt de reactiviteit.
* isomeren: Koolwaterstoffen met dezelfde moleculaire formule kunnen verschillende structuren hebben (isomeren). Isomeren kunnen verschillende fysische en chemische eigenschappen hebben.
2. Fysieke eigenschappen:
* Staat van materie: Bij kamertemperatuur zijn koolwaterstoffen met korte keten gassen, koolwaterstoffen met middellange keten zijn vloeistoffen en koolwaterstoffen met lange keten zijn vaste stoffen.
* kookpunt: Het kookpunt neemt toe met toenemende kettinglengte en neemt af met vertakking.
* smeltpunt: Smeltpunt neemt toe met toenemende kettinglengte en wordt ook beïnvloed door vertakking.
* Dichtheid: Koolwaterstoffen zijn over het algemeen minder dicht dan water, waardoor ze drijven.
* Oplosbaarheid: Koolwaterstoffen zijn over het algemeen niet -polair en daarom onoplosbaar in water (hydrofoob). Ze zijn oplosbaar in niet -polaire oplosmiddelen zoals ether en hexaan.
* Vijnbaarheid: Koolwaterstoffen zijn ontvlambaar, wat betekent dat ze gemakkelijk in aanwezigheid van zuurstof verbranden, waardoor energie wordt vrijgelaten in de vorm van warmte en licht.
3. Chemische eigenschappen:
* verbranding: Koolwaterstoffen reageren met zuurstof om koolstofdioxide, water en warmte te produceren. Dit is de basis voor het gebruik van koolwaterstoffen als brandstoffen.
* vervangingsreacties: Alkanen ondergaan substitutiereacties, waarbij een waterstofatoom wordt vervangen door een ander atoom of groep.
* toevoegingsreacties: Alkenen en alkynes ondergaan extra reacties, waarbij atomen of groepen worden toegevoegd over de dubbele of drievoudige binding.
* Uitdroging: Koolwaterstoffen kunnen worden uitgedroogd (verlies van water) om meer onverzadigde koolwaterstoffen te vormen.
4. Toepassingen:
* brandstoffen: Koolwaterstoffen zijn de primaire energiebron voor transport en het genereren van elektriciteit.
* petrochemicals: Koolwaterstoffen worden gebruikt om een breed scala aan producten te produceren, waaronder kunststoffen, synthetisch rubber en meststoffen.
* smeermiddelen: Koolwaterstoffen met lange keten worden gebruikt als smeermiddelen om wrijving tussen bewegende delen te verminderen.
* oplosmiddelen: Koolwaterstoffen worden gebruikt als oplosmiddelen in veel industriële processen.
Belangrijke opmerking: De specifieke eigenschappen van een koolwaterstof zijn afhankelijk van zijn individuele structuur. Dit brede overzicht biedt een algemeen begrip van koolwaterstofeigenschappen.
Hoofdlijnen
- Wat maakt celdeling nauwkeurig?
- Welk phylum zijn orang -oetans?
- Wat zijn de voordelen en nadelen van Flow Cytometry?
- Wat zijn 2 manieren waarop wetenschappers resultaten delen?
- Welke microscopische organismen leven in de bodem?
- Wat is de functie van een irisdiafragma op een microscoop?
- Wat betekent de term hybride voor de wetenschap?
- Waar hangen alle organismen in een voedselweb uiteindelijk van?
- Wetenschappers ontdekken hoe een motoreiwit cellen helpt bewegen
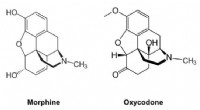
- Minder verslavende opioïden ontwerpen door middel van chemie
- Computerprogramma kan een 2D-tekening in vrije vorm vertalen naar een DNA-structuur
- Antibacteriële sportkleding? De claim is net zo absurd als het klinkt

- methaanthiol, een potentiële nieuwe grondstof in de C1-chemie

- Zijderupsen zorgen voor een nieuwe draai aan kleverige moleculen

 Wat doet een boomhopper met de omgeving?
Wat doet een boomhopper met de omgeving?  Stel dat de temperatuur van de lucht in een ballon toeneemt als de druk constant blijft. Welke hoeveelheid moet dan veranderen? Zou het volume of aantal moleculen zijn Samendrukbaarheid OF Adhesie?
Stel dat de temperatuur van de lucht in een ballon toeneemt als de druk constant blijft. Welke hoeveelheid moet dan veranderen? Zou het volume of aantal moleculen zijn Samendrukbaarheid OF Adhesie?  Wanneer een raket maximale hoogte bereikt, wat is zijn snelheid?
Wanneer een raket maximale hoogte bereikt, wat is zijn snelheid?  Waar is tussen de zon en de maan tijdens een maansverduistering?
Waar is tussen de zon en de maan tijdens een maansverduistering?  Wat zijn de aanpassingen voor overleving voor zeegras?
Wat zijn de aanpassingen voor overleving voor zeegras?  Innovatief model gemaakt voor NASA om vitamineniveaus in voedsel voor ruimtevluchten te voorspellen
Innovatief model gemaakt voor NASA om vitamineniveaus in voedsel voor ruimtevluchten te voorspellen Onderzoekers gezocht:mensen hoeven niet te solliciteren?
Onderzoekers gezocht:mensen hoeven niet te solliciteren?  Wat veroorzaakt een neerslagreactie tussen twee oplosbare verbinding?
Wat veroorzaakt een neerslagreactie tussen twee oplosbare verbinding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


