
Wetenschap
Wat is de polariteit van waterstofjodide?
Waterstofjodide (HI) is een polair molecuul . Dit is waarom:
* Elektronegativiteitsverschil: Jodium is aanzienlijk elektronegatief dan waterstof. Dit betekent dat jodium de gedeelde elektronen in de H-I-binding sterker aantrekt.
* ongelijke elektronenuitwisseling: Het ongelijke delen van elektronen creëert een gedeeltelijke negatieve lading (δ-) op het jodiumatoom en een gedeeltelijke positieve lading (Δ+) op het waterstofatoom.
* Dipoolmoment: De scheiding van lading creëert een dipoolmoment, waarbij het jodiumuiteinde van het molecuul enigszins negatief is en het waterstofuiteinde enigszins positief is.
Daarom is waterstofjodide een polair molecuul.
Hoofdlijnen
- Welk proces stelt cellen in staat om naar de cel te gaan zonder gebruik van chemische energie?
- Wat bevatten organismen om hydrolysereacties in cellen te katalyseren?
- Welk systeem reguleert de groei van het metabolisme en de functies van seksuele organen?
- Je laat een microbe-vingerafdruk achter op elk kledingstuk dat je draagt – en het kan forensische wetenschappers helpen misdaden op te lossen
- Welk type organisme geeft zuurstof vrij?
- Hoe schrijf je de complementaire streng en mRNA voor atggacaaactcaactca?
- Hoe de hersenen van fruitvliegen bepalen wat ze eten
- Welke van de volgende DNA-strengen is een complementaire streng voor C-C-A-T-C-G A. G-G-T-A-G-C C. A-A-C-G-A-T B. G-G-A-T-G-C D. T-T-G-C-T-A?
- Begrijpen hoe autoactivatie celdood veroorzaakt
- Zilver verbetert de efficiëntie van monograinlaagzonnecellen

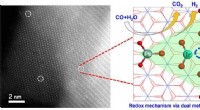
- Wetenschappers stellen redoxmechanisme voor water-gasverschuivingsreactie voor
- Alchemisten van de celomgeving

- Onderzoeksteam ontwikkelt nieuw systeem om hersenchemicaliën te volgen
- Machine learning ontdekt nieuwe sequenties om medicijnafgifte te stimuleren
 Wat is het verschil tussen ruimtefysica en Astro -fysica?
Wat is het verschil tussen ruimtefysica en Astro -fysica?  Wetenschappers ontdekken een miljardenjarig epos dat geschreven is over de chemie van het leven
Wetenschappers ontdekken een miljardenjarig epos dat geschreven is over de chemie van het leven  Onderzoek laat zien hoe intermitterend vasten veroudering reguleert via autofagie
Onderzoek laat zien hoe intermitterend vasten veroudering reguleert via autofagie  Chemie -modelvragen van plus één?
Chemie -modelvragen van plus één?  Is CO2 slecht voor de planeet?
Is CO2 slecht voor de planeet?  We wedden dat we weten wat je favoriete nummer is
We wedden dat we weten wat je favoriete nummer is  Simulaties laten een verhoogde jetstream-golving zien als gevolg van een asymmetrische stijging van de mondiale temperaturen
Simulaties laten een verhoogde jetstream-golving zien als gevolg van een asymmetrische stijging van de mondiale temperaturen  Welke beschrijft hoe vroege mensen wind- en zonne -kracht voor hetzelfde doel gebruikten?
Welke beschrijft hoe vroege mensen wind- en zonne -kracht voor hetzelfde doel gebruikten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


