
Wetenschap
Hoeveel gram zuurstof wordt geproduceerd wanneer 11,5 NO2 wordt gevormd?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie die u beschrijft, is de ontleding van stikstofmonoxide (NO) om stikstofdioxide (NO₂) en zuurstof (O₂) te vormen:
2no (g) + o₂ (g) → 2no₂ (g)
2. Bepaal de molverhouding:
Uit de evenwichtige vergelijking zien we dat voor elke 2 mol No₂ geproduceerd, 1 mol O₂ wordt geproduceerd.
3. Bereken de mol No₂:
U moet de gegeven hoeveelheid No₂ (11,5 g) omzetten in mol met behulp van de molaire massa.
* Molaire massa van No₂ =14,01 g/mol (n) + 2 * 16.00 g/mol (O) =46.01 g/mol
* Mol no₂ =(11,5 g no₂) / (46.01 g / mol no₂) =0,25 mol No₂
4. Bereken de mol O₂:
Gebruik van de molverhouding van de gebalanceerde vergelijking:
* Mol o₂ =(0,25 mol No₂) * (1 mol o₂ / 2 mol No₂) =0,125 mol o₂
5. Converteer mol O₂ om te grammen:
* Molaire massa van o₂ =2 * 16.00 g/mol =32,00 g/mol
* Gram van o₂ =(0,125 mol o₂) * (32,00 g/mol o₂) = 4,00 g o₂
Daarom wordt 4,00 gram zuurstof geproduceerd wanneer 11,5 gram No₂ wordt gevormd.
 Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water Hoe zei Rutherford dat atomen eruit zagen?
Hoe zei Rutherford dat atomen eruit zagen?  Wat is het aantal E-P en N in een neutraal atoomstikstof?
Wat is het aantal E-P en N in een neutraal atoomstikstof?  Een zuivere stof die niet in andere stoffen kan worden opgesplitst in andere stoffen op chemische middelen?
Een zuivere stof die niet in andere stoffen kan worden opgesplitst in andere stoffen op chemische middelen?  Welke formule vertegenwoordigt een niet-polair molecuul?
Welke formule vertegenwoordigt een niet-polair molecuul?
 Onderzoekers nemen tips van Twister om ongrijpbare stormgegevens op te sporen
Onderzoekers nemen tips van Twister om ongrijpbare stormgegevens op te sporen Waarom betreffen zoveel weersbanen dieren?
Waarom betreffen zoveel weersbanen dieren?  Waarom zijn de golven aan de Amerikaanse westkust groter dan de golven van
Waarom zijn de golven aan de Amerikaanse westkust groter dan de golven van  Hoe beïnvloeden de natuurlijke hulpbronnen en het klimaat van een geografie de mondiale partnerschappen van de economie met andere landen?
Hoe beïnvloeden de natuurlijke hulpbronnen en het klimaat van een geografie de mondiale partnerschappen van de economie met andere landen?  Mediterrane regenval onmiddellijk beïnvloed door veranderingen in broeikasgassen
Mediterrane regenval onmiddellijk beïnvloed door veranderingen in broeikasgassen
Hoofdlijnen
- Wat is een voorbeeld van evolutie vandaag?
- Hoe Barbastelle-vleermuizen motten misleiden die hun echolocatie-oproepen kunnen horen
- Hoe kun je een kern identificeren door naar cel door microscoop te kijken?
- Statisticus helpt bij het oplossen van geschillen over de manier waarop genexpressie wordt gecontroleerd
- Zou jong bloed geheimen kunnen bevatten voor een langer en gezonder leven?
- Hoeveel delen is het menselijk lichaam verdeeld?
- Onderzoekers ontdekken een evolutionaire opstap naar bietenrode bieten
- Wat is een complex koolhydraat gevonden in de celwanden van schimmels en insectenexoskeletten?
- Amylase Activity in the Stomach
- Voeg gewoon water toe:scheikundigen suggereren een oplossing voor onoplosbare medicijnen
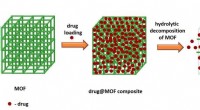
- Nieuw onderzoek vindt ontbrekende schakel tussen hechting van zachte oppervlakken en oppervlakteruwheid

- Een tweestapsbenadering gebruiken om alifatische amines om te zetten in onnatuurlijke aminozuren
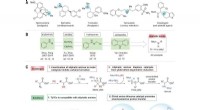
- Stokken en stenen kunnen je botten breken, maar deze reactie bewerkt skeletten

- Dit servies van suikerriet en bamboe breekt in 60 dagen af

 Hoeveel gram water zijn er in 400 ml?
Hoeveel gram water zijn er in 400 ml?  Een nieuw polymeer legt de lat hoger voor lithium-zwavelbatterijen
Een nieuw polymeer legt de lat hoger voor lithium-zwavelbatterijen Wat voor soort energie veroorzaakt wind?
Wat voor soort energie veroorzaakt wind?  Hoe verschilt de vorming van stollingsrots van die metamorfe rots?
Hoe verschilt de vorming van stollingsrots van die metamorfe rots?  Trio van afstemmingstools voor het modelleren van grote ruimtelijke datasets
Trio van afstemmingstools voor het modelleren van grote ruimtelijke datasets Welk effect heeft zelfs dunne stofwolken op het licht dat er doorheen gaat?
Welk effect heeft zelfs dunne stofwolken op het licht dat er doorheen gaat?  Hoe wordt de snelheid van een vliegtuig gemeten?
Hoe wordt de snelheid van een vliegtuig gemeten?  Optische gegevensverwerking profiteert van nieuw soort mobiliteit
Optische gegevensverwerking profiteert van nieuw soort mobiliteit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

