
Wetenschap
Hoe zei Rutherford dat atomen eruit zagen?
* atomen zijn meestal lege ruimte: De overgrote meerderheid van de alfa -deeltjes gingen dwars door de gouden folie, wat aangeeft dat atomen meestal lege ruimte zijn.
* Een kleine, dichte, positief geladen kern: Een kleine fractie alfa -deeltjes werd onder grote hoeken afgebogen, of zelfs teruggekaatst. Dit bracht Rutherford ertoe om het bestaan van een kleine, dichte, positief geladen kern in het midden van het atoom voor te stellen.
* Elektronen rond de kern: Om rekening te houden met de algehele neutraliteit van een atoom, theoretiseerde Rutherford dat negatief geladen elektronen de positief geladen kern zoals planeten rond de zon ronddraaien.
Dit model had echter enkele beperkingen:
* Het verklaarde niet waarom elektronen niet in de kern kronkel: Volgens de klassieke fysica moeten draaitelelektronen energie verliezen en uiteindelijk botsen met de kern.
* Het kon niet de verschillende spectrale lijnen verklaren die door atomen worden uitgestoten: Dit werd later verklaard door de ontwikkeling van de kwantummechanica.
Het model van Rutherford was een belangrijke doorbraak in ons begrip van het atoom, maar het werd uiteindelijk vervangen door het meer accurate Bohr -model en later het kwantummechanische model.
Hoofdlijnen
- Waar zit zoutzuur in de voedselmassa?
- Hoe snelgroeiende algen de groei van voedselgewassen kunnen verbeteren
- Waarom witte honden dat zijn
- Het magische staatspark in Californië dat geen bezoekers toestaat
- Nieuwe studie verklaart mechanismen van zouttransport en kan helpen bij de behandeling van cystische fibrose
- Een nieuwe diagnose voor de diagnostiek en behandeling van visherpesvirussen
- Wat voor soort cel komt uit mitotische divisie?
- Hoeveel soorten weefsel maken onze hersenen?
- Wanneer het celmembraan vloeistofdruppeltjes overspoelt, wordt het genoemd?
- Onderzoekers vinden H-C-bindingen wanneer waterstofatomen met hoge snelheid botsen met grafeen
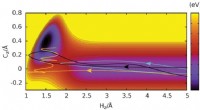
- Wetenschappers ontdekken een verborgen calcium-cholesterolverbinding

- De bidsprinkhaangarnalen perfect schild

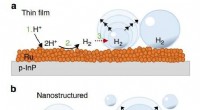
- Opwekking van waterstof op zonne-energie efficiënter maken in microzwaartekracht
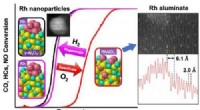
- Toekomstige katalysatoren kunnen meer waar voor je geld geven
 Luchtvervuilingskenmerken
Luchtvervuilingskenmerken Onderzoekers controleren de eigenschappen van licht met behulp van nanostructuren
Onderzoekers controleren de eigenschappen van licht met behulp van nanostructuren Wat is de kracht die je laat versnellen als je valt?
Wat is de kracht die je laat versnellen als je valt?  Wat zijn de energie -input en output van een radio?
Wat zijn de energie -input en output van een radio?  NASA zal in september een ruimtevaartuig neerstorten op een asteroïde van 150 meter breed. Hier leest u hoe u het kunt bekijken
NASA zal in september een ruimtevaartuig neerstorten op een asteroïde van 150 meter breed. Hier leest u hoe u het kunt bekijken  Hoe worden zonnevlammen gedetecteerd?
Hoe worden zonnevlammen gedetecteerd?  Hoe ver is de aarde van de zon in de zomer?
Hoe ver is de aarde van de zon in de zomer?  Designer-enzym gebruikt onnatuurlijk aminozuur voor katalyse
Designer-enzym gebruikt onnatuurlijk aminozuur voor katalyse
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


