
Wetenschap
Hoeveel mol natriumhydroxide reageert met 17 zwavelzuur?
1. Evenwichtige chemische vergelijking:
De evenwichtige chemische vergelijking voor deze reactie is:
2naOH + H₂so₄ → Na₂so₄ + 2H₂o
Dit vertelt ons dat 2 mol NaOH reageert met 1 mol h₂so₄.
2. We moeten de concentratie van het zwavelzuur kennen. U zorgde voor "17 zwavelzuur", maar dat is geen standaardeenheid. Bedoel je:
* 17 gram zwavelzuur?
* 17 ml zwavelzuur? (We hebben de concentratie nodig, bijvoorbeeld 17 ml 1 m zwavelzuur)
* 17 mol zwavelzuur?
Laten we aannemen dat je 17 gram zwavelzuur bedoelde.
3. Converteer gram van h₂so₄ naar mol:
* Zoek de molaire massa van H₂so₄:(2 x 1.01 g/mol) + (32,07 g/mol) + (4 x 16,00 g/mol) =98,08 g/mol
* Deel de massa van H₂so₄ door zijn molaire massa:17 g / 98,08 g / mol =0,173 mol H₂so₄
4. Bereken mol NaOH:
* Gebruik de molverhouding van de gebalanceerde vergelijking:2 mol NaOH:1 mol h₂so₄
* Vermenigvuldig de mol van H₂so₄ met de molverhouding:0,173 mol H₂so₄ * (2 mol NaOH / 1 mol H₂so₄) =0,346 mol NaOH
Daarom zal ongeveer 0,346 mol natriumhydroxide reageren met 17 gram zwavelzuur.
Belangrijke opmerking: Controleer de eenheden altijd en zorg ervoor dat u de juiste informatie hebt voordat u berekeningen uitvoert.
 Crystal Grids maken:een stapsgewijze handleiding
Crystal Grids maken:een stapsgewijze handleiding  Waarom kleine microben een grote factor kunnen zijn in de manier waarop klimaatverandering zich ontvouwt
Waarom kleine microben een grote factor kunnen zijn in de manier waarop klimaatverandering zich ontvouwt  Niet-klassieke fotosynthese door anorganische halfgeleidende mineralen van de aarde
Niet-klassieke fotosynthese door anorganische halfgeleidende mineralen van de aarde Het einde van de ontbossing in het Braziliaanse Amazonegebied?
Het einde van de ontbossing in het Braziliaanse Amazonegebied?  Hoe u stinkende insecten deze winter buiten kunt houden
Hoe u stinkende insecten deze winter buiten kunt houden
Hoofdlijnen
- Waarom vereisen eukaryotische cellen mitochondria?
- Wilde bijen worden bedreigd door huisbijen, invasieve soorten, ziekteverwekkers en klimaatverandering, maar wij kunnen helpen
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Hoe dinosaurusonderzoek de geneeskunde kan helpen
- Wat is mRNA? u moet op de hoogte zijn van het belangrijkste ingrediënt in sommige COVID-19-vaccins
- Onderzoekers vinden lage genetische diversiteit bij gedomesticeerde fretten
- Om een eiwit een integraal membraan te laten zijn, zou het wat hebben?
- Welke organel maakt eiwitassemblage mogelijk?
- Mariene wetenschappers ontdekken kleptopredatie - een nieuwe manier om prooien te vangen
- Onderzoekers leggen de unieke onderliggende atomaire structuur van PNCP-metaalglas uit

- Beoordeling van het begin van calciumfosfaatkiemvorming door gehyperpolariseerde real-time NMR

- Onderzoekers stellen vast hoe sorptiematerialen koolstof vangen en afgeven

- Moleculaire steigers helpen constructie op nanoschaal
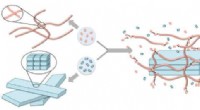
- Chemici onthullen de eerste manier om selenium in natuurlijke producten in te brengen
 Is de huid een vloeibare vaste stof of gas?
Is de huid een vloeibare vaste stof of gas?  Hoe groot is de komeet van Rosetta?
Hoe groot is de komeet van Rosetta?  De magie vinden die de hersenen aandrijft met behulp van een gigantische supercomputer
De magie vinden die de hersenen aandrijft met behulp van een gigantische supercomputer Het probleem van in massa geproduceerde moleculaire knooppunten kraken
Het probleem van in massa geproduceerde moleculaire knooppunten kraken Welke cel in uw lichaam slaat voedselwater en afvalproducten op?
Welke cel in uw lichaam slaat voedselwater en afvalproducten op?  Ingenieurs bedenken methode om high-res, 3D-beelden van objecten op nanoschaal
Ingenieurs bedenken methode om high-res, 3D-beelden van objecten op nanoschaal We wedden dat we weten wat je favoriete nummer is
We wedden dat we weten wat je favoriete nummer is  Wat is de formule die het moment van kracht definieert?
Wat is de formule die het moment van kracht definieert?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

