
Wetenschap
Wie heeft het sterkere dipool-dipool waterstofchloride of flouride?
Dit is waarom:
* Elektronegativiteitsverschil: Fluor is veel elektronegatiefer dan chloor. Dit betekent dat het fluoratoom in HF de gedeelde elektronen veel sterker naar zichzelf trekt, waardoor een grotere gedeeltelijke negatieve lading op de fluor en een grotere gedeeltelijke positieve lading op de waterstof ontstaat. Dit resulteert in een sterker dipoolmoment in HF.
* Kleinere fluorformaat: Fluor is kleiner dan chloor, wat leidt tot een meer geconcentreerde gedeeltelijke negatieve lading op het fluoratoom. Dit verbetert verder de dipool-dipool-interacties in HF.
Samenvattend: Het grotere elektronegativiteitsverschil en kleinere fluorgrootte in HF dragen bij aan sterkere dipool-dipoolinteracties in vergelijking met HCL.
 Wat is de methode van transport voor verplaatsing natriumionen in cel en kalium tussen plasma met rood bloed?
Wat is de methode van transport voor verplaatsing natriumionen in cel en kalium tussen plasma met rood bloed?  Wat is de oplosbaarheid van natriumchloride in water met een temperatuur 40 graden Celsius?
Wat is de oplosbaarheid van natriumchloride in water met een temperatuur 40 graden Celsius?  Hoeveel atomen in 2MGNO32?
Hoeveel atomen in 2MGNO32?  Wat is de methode om olie van azijn te scheiden?
Wat is de methode om olie van azijn te scheiden?  Hoe contrasteert de conversie van water in een gasvormige toestand veel verbindingen?
Hoe contrasteert de conversie van water in een gasvormige toestand veel verbindingen?
Hoofdlijnen
- Boren koolhydraten erfelijke informatie op en verzenden ze erfelijke informatie?
- Hoe zoet het is:nieuw hulpmiddel voor het karakteriseren van plantensuikertransporteurs
- Wie zijn de beroemde bioloog en wat hun bijdragen?
- Wat is de basiseenheidsstructuur in alle organismen?
- Welke celorganellen zijn verantwoordelijk voor fotosynthese en cellulaire ademhaling?
- Uit langdurig onderzoek blijkt dat haring door klimaatverandering eerder in de Waddenzee arriveert
- Hoe doodt alcohol bacteriën?
- Welk voedsel bevat groene algen?
- Waarom gaan sommige materialen gemakkelijk door een celmembraan?
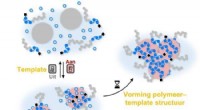
- Het polymerisatieproces in- en uitschakelen met een schakelbare sjabloon
- Technologische sprankje hoop voor de snowboardscene

- Onderzoek verbetert het enzym dat plastic afbreekt
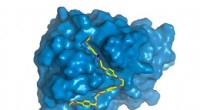
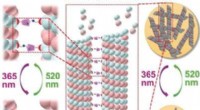
- Gebruik van zonlicht om de toekomst te voeden via covalente organische raamwerken

- Lichtgecontroleerde omkeerbare aggregatie van microtubuli gemedieerd door paclitaxel-gemodificeerd cyclodextrine
 LAMOST-Kepler/K2 survey maakt het eerste lichtresultaat bekend
LAMOST-Kepler/K2 survey maakt het eerste lichtresultaat bekend Zou het hebben van een eigen kloon hetzelfde zijn als een eeneiige tweeling?
Zou het hebben van een eigen kloon hetzelfde zijn als een eeneiige tweeling?  Zeldzame extreme heliumster geïdentificeerd door astronomen
Zeldzame extreme heliumster geïdentificeerd door astronomen Wat is de wetenschappelijke studie van aardbevingen?
Wat is de wetenschappelijke studie van aardbevingen?  Wat heeft energie?
Wat heeft energie?  Wat is de temperatuur van Proxima Centuari -ster?
Wat is de temperatuur van Proxima Centuari -ster?  Hoe stroomgebieden werken
Hoe stroomgebieden werken  Hoe beschadigen CFK's de ozonlaag?
Hoe beschadigen CFK's de ozonlaag?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

