
Wetenschap
Waarom is de chemische structuur HCCH niet chemisch logisch?
* valentie: Koolstof heeft een valentie van 4, wat betekent dat het vier bindingen kan vormen. In HCCH vormt elk koolstofatoom slechts twee bindingen (één met een andere koolstof en één met waterstof). Dit laat twee ongepaarde elektronen op elk koolstofatoom, waardoor het extreem reactief is.
* elektronegativiteit: Koolstof en waterstof hebben een vergelijkbare elektronegativiteit. Dit betekent dat er geen significante ladingscheiding is in het molecuul en de bindingen zijn in wezen niet -polair. Daarom zou HCCH de stabiliteit missen die wordt geboden door polaire bindingen.
In plaats van HCCH is de juiste weergave van het eenvoudigste alkeen C 2 H 2 , algemeen bekend als acetyleen . Deze structuur weerspiegelt nauwkeurig de bindingsopstelling:
* Triple Bond: De twee koolstofatomen vormen een drievoudige binding en delen zes elektronen. Dit voldoet aan de valentie -eisen voor beide koolstofatomen.
* lineaire geometrie: De drievoudige binding dwingt een lineaire geometrie, met alle vier atomen uitgelijnd in een rechte lijn.
De drievoudige binding in acetyleen is een bepalende functie, waardoor het een zeer reactief en nuttig molecuul is met verschillende toepassingen, zoals lassen en organische synthese.
 Hoe bereid je 2,5N h2so4?
Hoe bereid je 2,5N h2so4?  De luchtdruk wordt lager naarmate er watermoleculen aan de lucht worden toegevoegd, omdat .?
De luchtdruk wordt lager naarmate er watermoleculen aan de lucht worden toegevoegd, omdat .?  Welk gesteente is het meest effectief bij het bufferen van zure neerslag?
Welk gesteente is het meest effectief bij het bufferen van zure neerslag?  Kooldioxide omzetten in waardevolle producten
Kooldioxide omzetten in waardevolle producten Welke chemische reactie vindt plaats in het lichaam als je bang bent?
Welke chemische reactie vindt plaats in het lichaam als je bang bent?
 Aardverschuivingen hebben langetermijneffecten op de toendravegetatie
Aardverschuivingen hebben langetermijneffecten op de toendravegetatie Hoe de jacht mensen tot langeafstandslopers heeft gemaakt
Hoe de jacht mensen tot langeafstandslopers heeft gemaakt  Klimaatprojecties suggereren dat de maïsopbrengsten van Lancaster County in 2050 in gevaar komen
Klimaatprojecties suggereren dat de maïsopbrengsten van Lancaster County in 2050 in gevaar komen Bio vliegtuigbrandstoffen goed voor het klimaat, maar technologieën moeten worden aangepast
Bio vliegtuigbrandstoffen goed voor het klimaat, maar technologieën moeten worden aangepast Na Azië, palmolie kampt met verzet in Afrika
Na Azië, palmolie kampt met verzet in Afrika
Hoofdlijnen
- Wat zijn de 4 groepen stoffen die planten nodig hebben?
- Vorm een hypothese over de massa en het volume van een mol spliterwten?
- Hoe leeuwenbekken hun kleur behouden:bewegwijzeringstruc onthult evolutionair mechanisme
- Wat hebben xerofyt en freatofyt zo verschillend?
- Spanje meldt geval van gekkekoeienziekte
- Voordelen en nadelen van Hydrostatic Skeleton
- Wat is menselijke selectie?
- Wat is de studie van mensenplanten en dieren?
- Is eiwitexpressie en zuivering een wetenschappelijk proces?
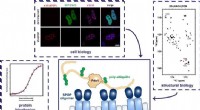
- Hoe weet een regulerend eiwit waar het moet binden om de insulineproductie te moduleren?
- Geoptimaliseerde verbindingstechnologie opent de deur naar veilig gebruik van waterstof in de luchtvaartindustrie

- Doorbraak in chemische synthese houdt belofte in voor toekomstige antibiotica
- Hoe hoogkristallijne organisch-anorganische perovskietfilms voor zonnecellen te verkrijgen?

- Bacteriën met metaaldieet ontdekt in vuil glaswerk
 Journal beschrijft hoe de opwarming van de aarde de visserij in de wereld zal beïnvloeden
Journal beschrijft hoe de opwarming van de aarde de visserij in de wereld zal beïnvloeden  Onderzoek onderzoekt hoe toeristen reageren wanneer ze tijdens het reizen gevoelens van woede of angst tegenkomen
Onderzoek onderzoekt hoe toeristen reageren wanneer ze tijdens het reizen gevoelens van woede of angst tegenkomen  Siliciumanodes versterken batterijtechnologie
Siliciumanodes versterken batterijtechnologie Nieuwe resultaten om de katalytische eigenschappen van bimetaalnanodeeltjes te helpen verfijnen
Nieuwe resultaten om de katalytische eigenschappen van bimetaalnanodeeltjes te helpen verfijnen  Onderzoekers catalogiseren defecten die 2D-materialen verbazingwekkende eigenschappen geven
Onderzoekers catalogiseren defecten die 2D-materialen verbazingwekkende eigenschappen geven Welke structuur is waar pollenkorrels land en stok?
Welke structuur is waar pollenkorrels land en stok?  Hoe AI de wapenwedloop op het gebied van cyberbeveiliging vormgeeft
Hoe AI de wapenwedloop op het gebied van cyberbeveiliging vormgeeft Video:de aarde verbinden met de maan
Video:de aarde verbinden met de maan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

