
Wetenschap
Bij het raffineren van zilverherstel van nitraatoplossing betrof verplaatsing door kopermetaalschrijfreactie?
2AGNO₃ (aq) + cu (s) → cu (no₃) ₂ (aq) + 2ag (s)
Verklaring:
* agno₃ (aq) vertegenwoordigt zilvernitraat opgelost in water (waterige oplossing).
* cu (s) vertegenwoordigt massief koperen metaal.
* cu (no₃) ₂ (aq) vertegenwoordigt koper (II) nitraat opgelost in water.
* 2ag (s) vertegenwoordigt massief zilvermetaal.
Hoe het werkt:
1. Verplaatsing: Het meer reactieve koperen metaal verplaatst de minder reactieve zilverionen (Ag⁺) van de zilvernitraatoplossing.
2. Redox -reactie: Dit is een redox -reactie waarbij koper wordt geoxideerd (verliest elektronen) en zilver wordt verminderd (winst elektronen).
3. Vorming van kopernitraat: De gevormde koperionen (Cu²⁺) combineren vervolgens met de nitraationen (NO₃⁻) om koper (II) nitraat te maken.
4. vast zilver: De verplaatste zilverionen krijgen elektronen en worden massief zilvermetaal, die verder kunnen worden verzameld en verfijnd.
Sleutelpunten:
* Koper is een beter reductiemiddel dan zilver.
* De reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* Deze methode is een relatief eenvoudige en kosteneffectieve manier om zilver uit oplossingen te halen.
 Is een flat soda pop homogeen mengsel?
Is een flat soda pop homogeen mengsel?  Waar kwam het uranium dat werd gebruikt in de atoombom van Hiroshima vandaan?
Waar kwam het uranium dat werd gebruikt in de atoombom van Hiroshima vandaan?  Video:Kunnen we oceaanwater drinkbaar maken – en zouden we dat ook moeten doen?
Video:Kunnen we oceaanwater drinkbaar maken – en zouden we dat ook moeten doen? Hoeveel valentie -elektronen heeft metalloïden?
Hoeveel valentie -elektronen heeft metalloïden?  Wat is de verandering van een stof van de ene fysieke toestand naar de andere?
Wat is de verandering van een stof van de ene fysieke toestand naar de andere?
 Waarom is een regenmeter belangrijk?
Waarom is een regenmeter belangrijk?  Seismologen vermoeden dat een aardbeving bij de San Andreas-breuk op handen is, ondanks vreemde dempingsparameters
Seismologen vermoeden dat een aardbeving bij de San Andreas-breuk op handen is, ondanks vreemde dempingsparameters  Zeebodemdieren onderzoeken voor offshore hernieuwbare energie
Zeebodemdieren onderzoeken voor offshore hernieuwbare energie Waar kunt u een lijst met bomen vinden?
Waar kunt u een lijst met bomen vinden?  Atlantics Hurricane Oscars waterdamp gemeten door NASA's Terra Satellite
Atlantics Hurricane Oscars waterdamp gemeten door NASA's Terra Satellite
Hoofdlijnen
- Begrijpen hoe microbiota gedijen in hun menselijke gastheren
- Wat is een polygenetische eigenschap?
- Een RNA TREAT voor Halloween
- Wat is het eerste micro -organisme op aarde?
- Onderzoek laat zien hoe genen de bladarchitectuur beïnvloeden
- Wat is de definitie van classificatie -zelfstandig naamwoord?
- Hoe smaakcellen de foerageerstrategie van een heel dier kunnen controleren
- Hoe worden eiwitten in cellen gesynthetiseerd uit een kleine verzameling eenvoudige eerdere moleculen?
- Onderzoek werpt licht op hoe vleesetende planten de smaak voor vlees kregen
- Het perspectief op de oorsprong van enzymatische katalytische kracht veranderen
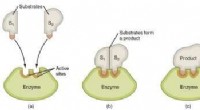
- Druk kan de sleutel zijn tot het bestrijden van klimaatverandering met thermo-elektrische generatoren

- Het periodiek systeem 180 graden draaien voor een nieuw perspectief
- Vermindering van plasticvervuiling door op RNA geïnspireerde breekpunten toe te voegen

- Invoeging van boor in alkyletherbindingen via tandemkatalyse van zink/nikkel
 Wat zijn de functies van kaliumjodidekristal?
Wat zijn de functies van kaliumjodidekristal?  Onderzoek onderzoekt manieren om de milieutoxiciteit van alomtegenwoordige zilveren nanodeeltjes te verminderen
Onderzoek onderzoekt manieren om de milieutoxiciteit van alomtegenwoordige zilveren nanodeeltjes te verminderen  Nieuwe lasertechniek identificeert de samenstelling van ruimtepuin, van beschilderde scherven tot teflon
Nieuwe lasertechniek identificeert de samenstelling van ruimtepuin, van beschilderde scherven tot teflon 'S Werelds kortste laserpuls
'S Werelds kortste laserpuls Wat voor soort organismen leven er in de tropische savanne?
Wat voor soort organismen leven er in de tropische savanne?  Waarom wordt zilvernitraat gebruikt in de chloridegrenstest?
Waarom wordt zilvernitraat gebruikt in de chloridegrenstest?  Welk steentype heeft grote kristallen in geen gewadderpatroon?
Welk steentype heeft grote kristallen in geen gewadderpatroon?  Hoe kan elk type energiebron worden omgezet in energie?
Hoe kan elk type energiebron worden omgezet in energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

