
Wetenschap
Waarom lost natriumchloride niet op in niet-polaire oplosmiddelen?
* Polariteit mismatch: Natriumchloride is een ionische verbinding, wat betekent dat het bestaat uit positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-). Deze ionen worden sterk tot elkaar aangetrokken door elektrostatische krachten en vormen een kristalroosterstructuur. Niet-polaire oplosmiddelen daarentegen missen een significante ladingscheiding en hebben zwakke intermoleculaire krachten. Deze polariteitsmismatch voorkomt dat de niet-polaire oplosmiddelmoleculen de sterke ionische bindingen in NaCl effectief overwinnen.
* "zoals oplost zoals": De algemene regel in de chemie is dat "zoals oplost zoals." Dit betekent dat polaire stoffen oplossen in polaire oplosmiddelen en niet-polaire stoffen lossen op in niet-polaire oplosmiddelen. Omdat NaCl zeer polair is, zal het alleen oplossen in polaire oplosmiddelen.
* Hydratatie: In water (een polair oplosmiddel), omringen de watermoleculen de Na+ en clies en vormen ze hydratatieschelpen. Deze hydratatieschalen helpen de ionische bindingen te verzwakken en de ionen te laten scheiden en op te lossen. Niet-polaire oplosmiddelen missen het vermogen om dergelijke hydratatieschalen te vormen, waardoor het voor de ionen onmogelijk is om los te komen van het kristalrooster.
* Energievereisten: Voor NaCl om op te lossen in een niet-polair oplosmiddel, zouden de oplosmiddelmoleculen voldoende energie moeten leveren om de sterke ionische bindingen in het kristalrooster te overwinnen. Niet-polaire oplosmiddelen hebben niet voldoende energie om deze bindingen effectief te verbreken.
Samenvattend, het ontbreken van polariteit in niet-polaire oplosmiddelen, de sterke ionische bindingen in NaCl en de afwezigheid van hydratatieschelpen voorkomen dat NaCl in deze oplosmiddelen oplost.
 Waarom wordt minerale olie toegevoegd aan het flesje dat limwater bevat?
Waarom wordt minerale olie toegevoegd aan het flesje dat limwater bevat?  Geconstrueerde insuline die kan worden geactiveerd door een hoge bloedsuikerspiegel kan de levenskwaliteit van diabetici verbeteren
Geconstrueerde insuline die kan worden geactiveerd door een hoge bloedsuikerspiegel kan de levenskwaliteit van diabetici verbeteren Waarom moeten chemische vergelijkingen in evenwicht worden gebracht volgens de wet van behoud van massa?
Waarom moeten chemische vergelijkingen in evenwicht worden gebracht volgens de wet van behoud van massa?  Wat is meer dichte vloeistof Xenon of Solid Xenon?
Wat is meer dichte vloeistof Xenon of Solid Xenon?  Bietsap gebruiken om een PH-schaal te maken
Bietsap gebruiken om een PH-schaal te maken
 Palmolieboycot zou de ontbossing juist kunnen vergroten – duurzame producten zijn de oplossing
Palmolieboycot zou de ontbossing juist kunnen vergroten – duurzame producten zijn de oplossing Duitsland is van plan om volgend jaar plastic boodschappentassen voor eenmalig gebruik te verbieden
Duitsland is van plan om volgend jaar plastic boodschappentassen voor eenmalig gebruik te verbieden Wetenschappers komen samen om het risico van microplasticvervuiling te bestuderen
Wetenschappers komen samen om het risico van microplasticvervuiling te bestuderen Wat zijn twee kenmerken van levende wezens?
Wat zijn twee kenmerken van levende wezens?  Wat wordt gepersonifieerd door de wind die in menselijke trekken door het donkere en sombere bos fluistert?
Wat wordt gepersonifieerd door de wind die in menselijke trekken door het donkere en sombere bos fluistert?
Hoofdlijnen
- Kauw hierop:de manier waarop wij denken dat ons vlees wordt grootgebracht, kan van invloed zijn op de smaak ervan
- Wat kunnen we leren van de microben op het schild van een schildpad?
- Hoe SARS-coronavirussen gastheercellen herprogrammeren in hun eigen voordeel
- Meloensmaak gedecodeerd:de genetische sleutels tot aromatische diversiteit
- De kwaliteit van bosbessen ontsluiten:de rol van cuticulaire was
- Een stap dichter bij gewassen met twee keer de opbrengst
- Hoe status aan genen kleeft
- Plankton is de kleinste onbezongen held op aarde
- Hoe zijn de wortels cruciaal om planten te overleven?
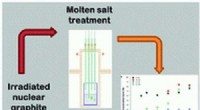
- Nieuwe behandelingstechnologie kan de belasting van nucleair afval in het VK verminderen
- Ultrasone trillingen dwingen een polymeer om een halfgeleider te zijn
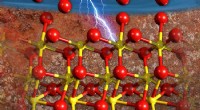
- Atomen herschikken in elektrolyt en regelen de ionenstroom onder zware omstandigheden
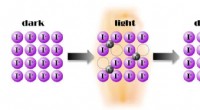
- Lichtgestuurd stroomtransport door geladen atomen voor het eerst gedemonstreerd
- Technologie gebruikt afval van plantaardige biomassa voor zelfaangedreven biomedische apparaten

 Super-mini-voertuigen vervoeren therapieën en beeldvormende middelen in het lichaam met mega-resultaten
Super-mini-voertuigen vervoeren therapieën en beeldvormende middelen in het lichaam met mega-resultaten Oprolbare tv's en buigbare smartphones:de toekomst van flexibele elektronische materialen
Oprolbare tv's en buigbare smartphones:de toekomst van flexibele elektronische materialen Afbeelding:Hubble vangt een kannibaal sterrenstelsel
Afbeelding:Hubble vangt een kannibaal sterrenstelsel Wat is Sun Sitara?
Wat is Sun Sitara?  Welke van de volgende heeft drie elektronen in zijn valentieschaalkoolstofaluminium natriumcalcium?
Welke van de volgende heeft drie elektronen in zijn valentieschaalkoolstofaluminium natriumcalcium?  Hoe lang in inches is 110 mm?
Hoe lang in inches is 110 mm?  Alles tegelijk gespoten:Ultradunne coatings gemaakt door gelijktijdige sproeien van op elkaar inwerkende stoffen
Alles tegelijk gespoten:Ultradunne coatings gemaakt door gelijktijdige sproeien van op elkaar inwerkende stoffen Tweetraps toediening van nanodeeltjes van piperlongumine en TRAIL-antikankertherapie
Tweetraps toediening van nanodeeltjes van piperlongumine en TRAIL-antikankertherapie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

