
Wetenschap
Hoe teken je een waterstof?
1. Het Bohr -model:
* cirkel: Teken een cirkel om de kern van het waterstofatoom weer te geven.
* dot: Plaats in de cirkel een kleine stip om het proton (het positief geladen deeltje) weer te geven.
* kleinere cirkel: Teken een veel grotere cirkel rond de eerste cirkel om de elektronenschaal weer te geven.
* kleinere punt: Plaats een kleinere stip op de buitenste cirkel om het elektron (het negatief geladen deeltje) weer te geven.
2. Het kwantummechanische model:
* Nucleus: Teken een kleine cirkel om de kern weer te geven.
* Cloud: Teken in plaats van een gedefinieerde baan een vage, wolkachtige vorm rond de kern om de kans te vertegenwoordigen om het elektron in die ruimte te vinden.
Belangrijke overwegingen:
* schaal: Deze modellen zijn niet op te schalen. De elektronenschil in het Bohr -model is veel groter dan de kern, maar in werkelijkheid is de kern veel, veel kleiner in vergelijking met de ruimte waar het elektron waarschijnlijk zal worden gevonden.
* vereenvoudigd: Deze modellen zijn vereenvoudigde representaties. Het feitelijke gedrag van elektronen in atomen is complexer en wordt beschreven door de kwantummechanica.
Hier zijn enkele voorbeelden:
* Bohr -model:
* [https://www.google.com/search?q=bohr+model+hydrogen&tbm=isch buch(https://www.google.com/search?q=bohr+model+hydrogen&tbm=isch)
* Kwantummechanisch model:
* [https://www.google.com/search?q=Quantum+mechanical+Model+hydrogen&tbm=ischBuch(https://www.google.com/search?q=Quantum+mechanical+ Model+hydrogen&tbm=isch)
Laat het me weten als je nog andere vragen hebt.
 Is NACI een compound of mengsel?
Is NACI een compound of mengsel?  Het gebruik van schaaldieren bij het genezen van wonden - de toekomst van de geneeskunde?
Het gebruik van schaaldieren bij het genezen van wonden - de toekomst van de geneeskunde? Wat is de chemische vergelijking voor de ontleeding van ammoniumnitraat in stikstof en water?
Wat is de chemische vergelijking voor de ontleeding van ammoniumnitraat in stikstof en water?  Hoe tanden bleken werkt
Hoe tanden bleken werkt  Begrijpen hoe rood zeewier de methaanuitstoot van koeien vermindert
Begrijpen hoe rood zeewier de methaanuitstoot van koeien vermindert
 Waarom koolstofvrije huizen het groene herstel van COVID-19 moeten leiden
Waarom koolstofvrije huizen het groene herstel van COVID-19 moeten leiden Nieuwe klimaatwetenschap toont potentieel voor hogere zeespiegelstijging
Nieuwe klimaatwetenschap toont potentieel voor hogere zeespiegelstijging Wat is voorbeelden van behoud?
Wat is voorbeelden van behoud?  Sedimenten in de Noordelijke IJszee onthullen het ontdooien van de permafrost tijdens de klimaatopwarming in het verleden
Sedimenten in de Noordelijke IJszee onthullen het ontdooien van de permafrost tijdens de klimaatopwarming in het verleden Ramplessen:wat je niet weet, kan dodelijk zijn
Ramplessen:wat je niet weet, kan dodelijk zijn
Hoofdlijnen
- Voor een gestreepte mangoest in het noorden van Botswana, communiceren met familie kan dodelijk zijn
- Reconstructie van alternatieve paden naar complexe meercelligheid bij dieren en schimmels op basis van de huidige genetische diversiteit
- Hoe je hersenen werken
- Heeft de kern iets nodig om goed te functioneren?
- Waar bestaat de biosfeer uit?
- Lichtshow in levende cellen:nieuwe methode maakt gelijktijdige fluorescerende labeling van veel eiwitten mogelijk
- Twee nieuwe Engelhardia-soorten van de walnootfamilie gemeld
- Hoe de hersenen geuren buitensluiten
- Onderzoekers ontsluiten hoe cellen hun functies bepalen
- Huidvaccinatie met micronaaldpleister, influenzafusie-eiwit verbetert de werkzaamheid van griepvaccins

- Hoe u vlakglas perfect om hoeken buigt

- Infraroodsensor dient als een nieuw hulpmiddel voor het ontdekken van medicijnen

- Corrosiebestendigheid van stalen staven in beton bij vermenging met aerobe micro-organismen
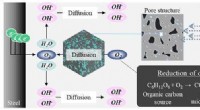
- Onderzoekers ontwikkelen katalysator voor selectieve omzetting van reactieve lithiumverbindingen
 Kerk, bank, koppel:Sociaal-psychologische verbindingen tussen mensen en fysieke ruimte
Kerk, bank, koppel:Sociaal-psychologische verbindingen tussen mensen en fysieke ruimte Comcast overtreft winstprognoses; kabel-tv abonnementen dalen
Comcast overtreft winstprognoses; kabel-tv abonnementen dalen Wat bepaalt de Earths Revolution?
Wat bepaalt de Earths Revolution?  Waarom kunnen elementen in de zon worden geproduceerd, maar niet in de aardatmosfeer?
Waarom kunnen elementen in de zon worden geproduceerd, maar niet in de aardatmosfeer?  Wat is een verwijderbaar IR -gesneden filter?
Wat is een verwijderbaar IR -gesneden filter?  Waarom golfbaangras er zo perfect uitziet
Waarom golfbaangras er zo perfect uitziet  Materialen voor zonnebatterijen van de nieuwe generatie worden gemaakt bij SUSU
Materialen voor zonnebatterijen van de nieuwe generatie worden gemaakt bij SUSU Het geheim van het weerstaan van klimaatverandering ligt aan onze voeten
Het geheim van het weerstaan van klimaatverandering ligt aan onze voeten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

