
Wetenschap
Wat zijn de verschillen tussen moleculaire bindingen en ionische bindingen?
moleculaire bindingen (covalente bindingen)
* Formatie: Atomen delen elektronen om een stabiele elektronenconfiguratie te bereiken (meestal een volledige buitenste schaal).
* elektronegativiteit: Bij betrokken atomen hebben vergelijkbare elektronegativiteiten (aantrekkingskracht voor elektronen). Het verschil in elektronegativiteit is klein, meestal minder dan 1,7.
* bindtype: Delen van elektronen.
* resulterende verbindingen: Meestal vormen moleculen (discrete eenheden), vaak gassen of vloeistoffen bij kamertemperatuur.
* eigenschappen:
* Lagere smelt- en kookpunten: Omdat de bindingen zwakker zijn, is er minder energie nodig om ze te breken.
* Typisch niet-geleidend: Elektronen zijn gelokaliseerd in het molecuul, niet vrij om te bewegen.
* kan polair of niet-polair zijn: Hangt af van de symmetrie van het molecuul en het elektronegativiteitsverschil tussen de atomen.
Voorbeelden:
* Water (H₂o) - De waterstof- en zuurstofatomen delen elektronen.
* Methaan (CH₄) - Koolstof- en waterstofatomen delen elektronen.
ionische bindingen
* Formatie: Eén atoom (meestal een metaal) verliest een of meer elektronen en wordt een positief geladen ion (kation). Een ander atoom (meestal een niet-metaal) krijgt deze elektronen en wordt een negatief geladen ion (anion). Tegengestelde ladingen trekken aan en vormen de obligatie.
* elektronegativiteit: Bij betrokken atomen hebben aanzienlijk verschillende elektronegativiteiten. Het verschil in elektronegativiteit is meestal groter dan 1,7.
* bindtype: Elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen.
* resulterende verbindingen: Vorm ionische verbindingen (zouten), vaak kristallijne vaste stoffen bij kamertemperatuur.
* eigenschappen:
* Hoog smelten- en kookpunten: Sterke elektrostatische krachten vereisen veel energie om te breken.
* Geleidend wanneer opgelost of gesmolten: Gratis ionen kunnen elektrische stroom dragen.
* vaak bros: De rigide structuur kan gemakkelijk breken.
Voorbeelden:
* Natriumchloride (NaCl) - Natrium verliest een elektron om NA⁺ te worden, terwijl chloor een elektron krijgt om Cl⁻ te worden.
* Magnesiumoxide (MGO) - Magnesium verliest twee elektronen om mg²⁺ te worden, en zuurstof krijgt twee elektronen om o²⁻ te worden.
Sleutelpunt: De classificatie van een binding als puur ionisch of covalent is vaak een vereenvoudiging. Veel bindingen hebben kenmerken van beide. De term "polaire covalente" wordt gebruikt wanneer er een ongelijke delen van elektronen is, wat leidt tot een enigszins positief en enigszins negatief uiteinde van het molecuul.
 Wat zou het totale potentieel zijn voor 3Ag2S 2Al(s) -- Al2S3 6Ag(s)?
Wat zou het totale potentieel zijn voor 3Ag2S 2Al(s) -- Al2S3 6Ag(s)?  Nieuwe reactie kan leiden tot een alternatieve benadering van ammoniakproductie
Nieuwe reactie kan leiden tot een alternatieve benadering van ammoniakproductie Welke twee stoffen moeten ijzer roesten?
Welke twee stoffen moeten ijzer roesten?  Hoe schrijf je fosfide dat ion bevat?
Hoe schrijf je fosfide dat ion bevat?  Hoe kan een oplossing van koperchloride en water worden gescheiden in de startstoffen?
Hoe kan een oplossing van koperchloride en water worden gescheiden in de startstoffen?
Hoofdlijnen
- Wat is het motorneuron dat eindigt?
- Proteomics-onderzoek levert aanwijzingen op over de manier waarop tuberculose het immuunsysteem zou kunnen dwarsbomen
- Wat is een lantervish?
- Twee hersengebieden werken samen om vinken te helpen weten wanneer en hoe ze hun liedjes moeten afstemmen op specifieke situaties
- Team ontdekt hoe microsporidiaanse parasieten sprinkhanenzwermgedrag voorkomen
- Ingenieurs ontwerpen programmeerbare RNA-vaccins:tests op muizen laten zien dat ze werken tegen ebola, griep en veel voorkomende parasieten
- Hoe krijgt een embryo een volledige set genen?
- Lab kweekt modulaire materialen op macroschaal uit bacteriën
- Hoe profiteert virus van het plaatsen van hun genetische materiaal in een gastheercel?
- Nieuw flexibel materiaal verandert zijn poreuze aard bij blootstelling aan licht
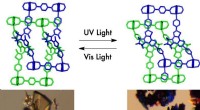
- Snelle oppervlaktedynamiek maakte koude verbinding van metalen glazen mogelijk

- Studie effent de weg voor nieuwe lichtgevoelige materialen

- Kleurveranderende verbanden detecteren en behandelen bacteriële infecties

- Chemici verbeteren de methode om natuurlijke antioxidanten uit laurierblaadjes te extraheren
 Hoeveel centimeter is 1,3 mm?
Hoeveel centimeter is 1,3 mm?  Hoe lichtvervuiling werkt
Hoe lichtvervuiling werkt  Een testbaar idee of uitleg dat leidt tot wetenschappelijk onderzoek?
Een testbaar idee of uitleg dat leidt tot wetenschappelijk onderzoek?  Wanneer een meisje begint te rennen, zet ze opgeslagen energie om?
Wanneer een meisje begint te rennen, zet ze opgeslagen energie om?  Hoe heeft Ernest Rutherford de wetenschappelijke methode gebruikt?
Hoe heeft Ernest Rutherford de wetenschappelijke methode gebruikt?  Algebra leren voor beginners
Algebra leren voor beginners Neurowetenschapper onderzoekt 'Hoe het is om een hond te zijn'
Neurowetenschapper onderzoekt 'Hoe het is om een hond te zijn'  Waarom wordt het minerale gips gebruikt bij het maken van gipsplaten?
Waarom wordt het minerale gips gebruikt bij het maken van gipsplaten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

