
Wetenschap
Waarom is het ionisatiepotentieel van stikstof meer dan zuurstof?
Elektronische configuratie:
* stikstof (n): 1S² 2S² 2p³
* zuurstof (O): 1S² 2S² 2P⁴
Belangrijke factoren:
1. half gevulde p-orbital: Stikstof heeft een half gevulde 2p orbitaal, wat betekent dat elk van de drie 2p orbitalen een enkel elektron bevat. Deze configuratie biedt extra stabiliteit vanwege:
* Regeling van elektronen-elektronen: Het hebben van één elektron in elk orbitaal minimaliseert de afstoting tussen elektronen.
* Uitwissel energie: Het vermogen van elektronen met dezelfde spin om posities uit te wisselen draagt bij aan stabiliteit.
2. Elektron-elektronafstoting in zuurstof: Zuurstof, met een 2P⁴ -configuratie, heeft twee elektronen in een van de 2P -orbitalen. Dit leidt tot verhoogde afstoting van elektronen-elektronen, waardoor het iets minder stabiel is dan stikstof.
Daarom:
Hoewel zuurstof één meer elektron heeft dan stikstof, biedt de halfgevulde P-orbitale configuratie in stikstof een grotere mate van stabiliteit. Het verwijderen van een elektron uit deze stabiele configuratie vereist meer energie, wat leidt tot een hoger ionisatiepotentieel voor stikstof in vergelijking met zuurstof.
Samenvattend: Het hogere ionisatiepotentieel van stikstof wordt toegeschreven aan de verbeterde stabiliteit van zijn half gevulde P-orbital, die zwaarder weegt dan het extra elektron in zuurstof.
 Welk reactiedocument van lijnen door Lakambini een sitoy?
Welk reactiedocument van lijnen door Lakambini een sitoy?  Wat is de verbinding met formule C3P2?
Wat is de verbinding met formule C3P2?  Versterkte fotokatalyse voor waterstofontwikkeling:toevoer van reactanten via fosfonaatgroepen
Versterkte fotokatalyse voor waterstofontwikkeling:toevoer van reactanten via fosfonaatgroepen Verbeterde menselijke bloed-hersenbarrière-chip voert in vivo-achtig transport van geneesmiddelen en antilichamen uit
Verbeterde menselijke bloed-hersenbarrière-chip voert in vivo-achtig transport van geneesmiddelen en antilichamen uit Waarom drijft gas op water?
Waarom drijft gas op water?
 Als het noodlot toeslaat, NASA brengt de kracht van de ruimte
Als het noodlot toeslaat, NASA brengt de kracht van de ruimte Lage snowpacks van 2014, 2015 kan steeds gebruikelijker worden met warmere omstandigheden
Lage snowpacks van 2014, 2015 kan steeds gebruikelijker worden met warmere omstandigheden Welk pad neemt het licht op wanneer een object moet worden gezien?
Welk pad neemt het licht op wanneer een object moet worden gezien?  Ruimtekolonies:hoe kunstmatige fotosynthese de sleutel kan zijn tot duurzaam leven buiten de aarde
Ruimtekolonies:hoe kunstmatige fotosynthese de sleutel kan zijn tot duurzaam leven buiten de aarde  Groene obligaties nemen een vlucht – en kunnen de planeet helpen redden
Groene obligaties nemen een vlucht – en kunnen de planeet helpen redden
Hoofdlijnen
- Later, alligator? Een vijfde van alle reptielensoorten zou kunnen uitsterven, zegt een nieuwe studie
- Welke hersenkern is de biologische klok?
- Hoe weet je of je plant rasechte en hybride is?
- Onderzoekers laten zien hoe nieuwe virussen evolueren en in sommige gevallen dodelijk worden
- Stopt mitochondriën niet meer functioneren in een eencellig organisme dat wordt blootgesteld aan verontreinigende stoffen duidt op het orgaansysteem?
- Is generalisatie belangrijk voor laboratoriumapparatuur?
- Wat is computergebruik in de wetenschap?
- Hoe slimme luiers kunnen helpen bij het ontwikkelen van nieuwe wapens in de strijd tegen bacteriën
- Blauw licht is de belangrijkste factor die de fotodegradatie van bladafval beïnvloedt
- Het onthullen van de nanostructuur van hout zou kunnen helpen de hoogtelimieten voor houten wolkenkrabbers te verhogen

- Slim materiaal maakt nieuwe toepassingen mogelijk in autonoom rijden en robotica

- Chemie op zonne-energie gebruikt koolstofdioxide en water om grondstoffen te maken voor brandstoffen, chemicaliën
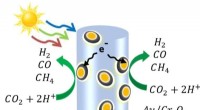
- Geblokkeerde beweging in moleculaire motor en rotor

- Kleine gels zuigen darmtoxines op
 Waarom zijn alle koolstof-koolstofbindingslengtes in benzeen gelijk?
Waarom zijn alle koolstof-koolstofbindingslengtes in benzeen gelijk?  Apples nieuwe flagshipstore in Chicago staat te koop, en kan $170 miljoen of meer opleveren
Apples nieuwe flagshipstore in Chicago staat te koop, en kan $170 miljoen of meer opleveren Wat zorgt ervoor dat de maan in de loop van de zon draait?
Wat zorgt ervoor dat de maan in de loop van de zon draait?  Onderzoekers combineren met succes twee verschillende materialen om nieuw hyperefficiënt lichtgevend kristal te creëren
Onderzoekers combineren met succes twee verschillende materialen om nieuw hyperefficiënt lichtgevend kristal te creëren Nieuw onderzoek maakt gebruik van optische solitonen in lasers om natuurlijk voorkomende supramoleculen te onderzoeken
Nieuw onderzoek maakt gebruik van optische solitonen in lasers om natuurlijk voorkomende supramoleculen te onderzoeken Waar zijn ecosystemen niet te vinden in Nepa?
Waar zijn ecosystemen niet te vinden in Nepa?  Wat Stel dat een fiets op een vlakke ondergrond uitrolt en er geen wrijving is. zou er iets met de snelheid gebeuren?
Wat Stel dat een fiets op een vlakke ondergrond uitrolt en er geen wrijving is. zou er iets met de snelheid gebeuren?  Hoe kwamen de TRAPPIST-1-planeten aan hun water?
Hoe kwamen de TRAPPIST-1-planeten aan hun water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

