
Wetenschap
Chemie op zonne-energie gebruikt koolstofdioxide en water om grondstoffen te maken voor brandstoffen, chemicaliën
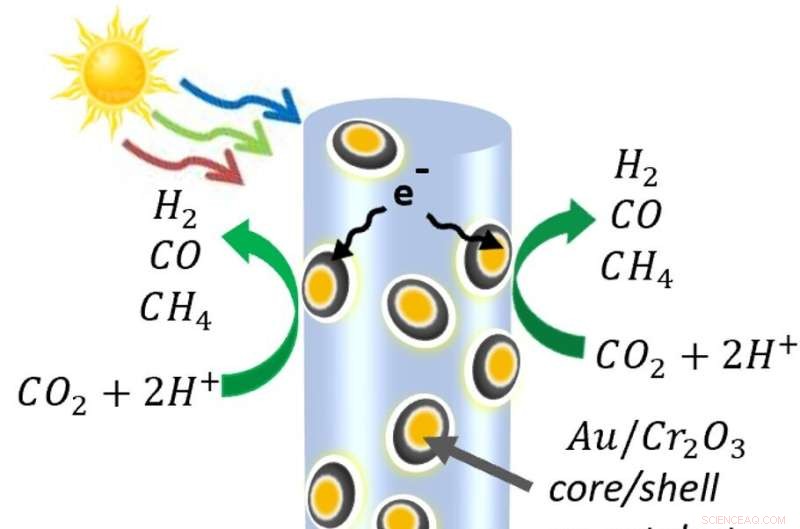
Een diagram van de halfgeleider nanodraden gemaakt van indium, gallium en stikstof, versierd met nanodeeltjes van goud en chroomoxide. Wanneer het licht de nanodraad raakt, maakt het elektronen vrij en de positief geladen "gaten" die elektronen achterlaten. Op de nanodraad zelf oxideren de gaten water tot protonen (waterstof) en zuurstof. Ondertussen worden sommige elektronen in de metalen nanodeeltjes getrokken, waar ze koolstofdioxide afbreken. De moleculen recombineren in de koolmonoxide-, waterstof- en methaanmoleculen waaruit syngas bestaat. Krediet:Roksana Rashid, McGill University.
Door zonne-energie aangedreven synthesegas zou koolstofdioxide kunnen recyclen tot brandstoffen en nuttige chemicaliën, heeft een internationaal team van onderzoekers aangetoond.
"Als we syngas kunnen genereren uit koolstofdioxide met alleen zonne-energie, kunnen we dit gebruiken als een voorloper voor methanol en andere chemicaliën en brandstoffen. Dit zal de totale CO2 aanzienlijk verminderen. emissies", zegt Zetian Mi, hoogleraar elektrische en computertechniek aan de Universiteit van Michigan, die de studie leidde die werd gepubliceerd in de Proceedings of the National Academy of Science .
Syngas, dat voornamelijk bestaat uit waterstof en koolmonoxide met een beetje methaan, wordt gewoonlijk met behulp van elektriciteit gewonnen uit fossiele brandstoffen. Bovendien worden vaak giftige chemicaliën toegevoegd om het proces efficiënter te maken.
"Ons nieuwe proces is eigenlijk vrij eenvoudig, maar het is opwindend omdat het niet giftig is, het is duurzaam en het is zeer kosteneffectief", zegt Roksana Rashid, eerste auteur van de studie, die de experimenten uitvoerde als doctoraalstudent in elektrotechniek en computertechniek aan McGill University in Canada.
Om een proces te creëren dat alleen zonne-energie gebruikt, overwon de groep van Mi de moeilijkheid om kooldioxidemoleculen te splitsen, die tot de meest stabiele in het universum behoren. Hiervoor doorspekten ze een woud van halfgeleider nanodraden met nanodeeltjes. Die nanodeeltjes, gemaakt van goud bedekt met chroomoxide, trokken de koolstofdioxidemoleculen aan en verbogen ze, waardoor de bindingen tussen koolstof en zuurstof werden verzwakt.
De nanodraden van galliumnitride gebruikten de lichtenergie om elektronen vrij te maken en de positief geladen ruimtes die ze achterlaten, ook wel gaten genoemd. De gaten splitsen watermoleculen en scheiden de protonen (waterstof) van de zuurstof. Vervolgens splitsen de elektronen bij de metaalkatalysatoren het kooldioxide, waarbij koolmonoxide wordt geproduceerd en soms de vrije waterstof wordt aangezogen om methaan te maken. Er zijn processen in ontwikkeling om de zuurstof van de andere gassen te scheiden.
"Onze technologie werpt licht op hoe gedistribueerde syngasproductie uit lucht, water en zonlicht kan worden opgebouwd", zegt Baowen Zhou, co-corresponderende auteur van de studie met Mi en een voormalig postdoctoraal onderzoeker in Mi's laboratorium aan de McGill University en U-M.
Door de verhouding van goud tot chroomoxide in de nanodeeltjes te veranderen, kon het team van Mi de relatieve hoeveelheden waterstof en koolmonoxide die in de reactie worden geproduceerd, beheersen. Dit is belangrijk omdat de verhouding tussen waterstof en koolmonoxide van invloed is op hoe gemakkelijk het is om een soort brandstof of chemische stof te produceren.
"Wat verrassend is, is de synergie tussen goud en chroomoxide om de CO2 reductie tot syngas efficiënt en afstembaar. Dat was niet mogelijk met een enkele metaalkatalysator," zei Mi. "Dit opent veel opwindende kansen die voorheen niet werden overwogen."
Mi's afstembare syngas-opstelling maakt gebruik van standaard industriële productieprocessen en is schaalbaar. Hoewel Rashid in dit experiment gedestilleerd water gebruikte, wordt verwacht dat zeewater en andere elektrolytoplossingen ook werken, en Mi heeft ze gebruikt in gerelateerde watersplitsingsstudies.
"De halfgeleider die we gebruiken als lichtabsorbeerder is gebaseerd op silicium en galliumnitride, de meest geproduceerde halfgeleiders, en we gebruiken heel weinig materiaal voor galliumnitride. Elke nanodraad is ongeveer één micrometer dik," zei Mi.
Het volgende doel van Mi is om de efficiëntie van het apparaat te verhogen, die momenteel op 0,89% staat. Wanneer 10% van de lichtenergie wordt omgezet in chemische energie, hoopt hij dat de technologie de technologie kan gebruiken voor hernieuwbare energie, vergelijkbaar met zonnecellen. + Verder verkennen
'Groen methaan' uit kunstmatige fotosynthese kan CO2 recyclen
 Nieuwe verbinding kan fotodynamische therapie voor kanker verbeteren
Nieuwe verbinding kan fotodynamische therapie voor kanker verbeteren Hoe Tantalium wordt gedolven
Hoe Tantalium wordt gedolven Nieuwe methode voor het 3D-printen van metaalopvangfilters om selectief edelmetalen te scheiden van afgedankte elektronische apparatuur
Nieuwe methode voor het 3D-printen van metaalopvangfilters om selectief edelmetalen te scheiden van afgedankte elektronische apparatuur Voordelen en nadelen van roestvrijstalen apparaten
Voordelen en nadelen van roestvrijstalen apparaten  Touchscreen-alternatief vermindert de angst voor een wereldtekort aan indium
Touchscreen-alternatief vermindert de angst voor een wereldtekort aan indium
 NASA vindt tropische depressie Bailu-vormen ten oosten van Filipijnen
NASA vindt tropische depressie Bailu-vormen ten oosten van Filipijnen Modelvergelijking voegt meer waarde toe bij het simuleren van extreme temperaturen in China
Modelvergelijking voegt meer waarde toe bij het simuleren van extreme temperaturen in China Onderzoek suggereert dat oesters een hotspot zijn voor het verminderen van vervuiling door nutriënten
Onderzoek suggereert dat oesters een hotspot zijn voor het verminderen van vervuiling door nutriënten Native Plants & Animals of China
Native Plants & Animals of China Bodemonderzoek geeft aanwijzingen voor het oude klimaat
Bodemonderzoek geeft aanwijzingen voor het oude klimaat
Hoofdlijnen
- Ideeën voor Cookie Science Fair Projects
- Biologische leeftijd verklaart variatie in reacties op stress
- Berekening van de tijd voor celverdubbeling
- Welke populatiestructuren maximaliseren de evolutionaire fitheid?
- Wanneer is de beste tijd van de dag om een beslissing te nemen?
- Ideeën voor het maken van een 3-D DNA-standaard voor middelbare school
- Nieuwe richtlijnen voor bestuivers zijn bedoeld om Ierlands landbouwgrond weer levendig te maken
- Zijn er verschillen tussen mannelijke en vrouwelijke pesters?
- Een kungfu-kick leidde onderzoekers naar 's werelds oudste complete visfossielen. Dit is wat ze hebben gevonden
- Berekende titrateerbare zuurgraad

- Onderzoekers ontwikkelen ultrakrachtige plasmonische metaaloxidematerialen

- Duurzame waterkwaliteitssensor gemaakt van van mensenhaar afgeleide koolstofstippen

- Out of the blue:Middeleeuwse fragmenten leveren verrassingen op

- Natuurkundigen meten moleculaire elektronische eigenschappen van vitamines

 Geen nieuwe fossiele brandstofprojecten voor netto-nul:IEA
Geen nieuwe fossiele brandstofprojecten voor netto-nul:IEA Lichte branden verbeteren de koolstofretentie van veengebieden op lange termijn
Lichte branden verbeteren de koolstofretentie van veengebieden op lange termijn Op grafeen gebaseerde geheugenweerstanden zijn veelbelovend voor op de hersenen gebaseerd computergebruik
Op grafeen gebaseerde geheugenweerstanden zijn veelbelovend voor op de hersenen gebaseerd computergebruik Het is minder dan 2 cm lang, maar deze 400 miljoen jaar oude fossiele vis verandert onze kijk op de evolutie van gewervelde dieren
Het is minder dan 2 cm lang, maar deze 400 miljoen jaar oude fossiele vis verandert onze kijk op de evolutie van gewervelde dieren Wat is ectoplasma?
Wat is ectoplasma?  In Afrikaanse feeënkringen, een sjabloon voor vele patronen uit de natuur
In Afrikaanse feeënkringen, een sjabloon voor vele patronen uit de natuur Klimaatverandering bedreigt de energiezekerheid van waterkrachtcentrales in het Amazonebekken
Klimaatverandering bedreigt de energiezekerheid van waterkrachtcentrales in het Amazonebekken Facebook-verwijderingen onthullen verfijning van Russische trollen
Facebook-verwijderingen onthullen verfijning van Russische trollen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

