
Wetenschap
Hoeveel waterstofatomen zou een booratoom nodig hebben om een covalent binding mee te vormen, zodat het stabiel is?
Dit is waarom:
* BORON's Electron Configuration: Boron heeft een atoomnummer van 5, wat betekent dat het 5 elektronen heeft. De elektronenconfiguratie is 1S²2S²2P¹.
* valentie -elektronen: Boron heeft drie elektronen in zijn buitenste (valentie) schaal (2s²2p¹).
* octetregel: Atomen hebben de neiging om elektronen te winnen, te verliezen of te delen om een stabiele configuratie van acht elektronen in hun valentieschil (de octetregel) te bereiken.
* Boor's stabiliteit: Boron kan stabiliteit bereiken door zijn drie valentie -elektronen te delen met drie waterstofatomen, waardoor drie covalente bindingen worden gevormd. Dit creëert een molecuul boraan (BH₃), waarbij Boron een volledige buitenste schaal van zes elektronen heeft.
Daarom heeft een booratoom drie waterstofatomen nodig om covalente bindingen te vormen en een stabiele elektronenconfiguratie te bereiken.
 Hoe reproduceren oesters?
Hoe reproduceren oesters?  NASA-enquêtetechniek schat de koolstof in Congo-bossen
NASA-enquêtetechniek schat de koolstof in Congo-bossen Grondwaterpompen drogen Great Plains-stromen op, uitsterven van vissen stimuleren
Grondwaterpompen drogen Great Plains-stromen op, uitsterven van vissen stimuleren Onderzoek naar het risico van metaalverontreiniging in inactieve mijnen kan helpen bij terugwinningsinspanningen
Onderzoek naar het risico van metaalverontreiniging in inactieve mijnen kan helpen bij terugwinningsinspanningen NASA's AIRS-beelden Tropische storm Barry voor aanlanding
NASA's AIRS-beelden Tropische storm Barry voor aanlanding
Hoofdlijnen
- Wat is een exact duplicaat van organisme dat wordt genoemd?
- Wat is het belangrijkste proces voor informatieopslag en overdracht naar nakomelingencellen?
- Hoe gist reageert op verandering:Ontwikkeling van een nieuw protocol maakt het mogelijk om complete set eiwitniveaus te meten
- Onderzoek naar de veelzijdige rol van MicroRNA156 in tuinbouwplanten
- Waarom bereiken de meeste organismen zelden hun biotische potentieel?
- Heeft de pH van water invloed op groeireparaten?
- Gevangen met zeep:begrijpen hoe zeepmoleculen eiwitten helpen in en uit vorm te komen
- Welke dieren hebben witte sclera?
- Wat is de naam van dikke lagere end spijsverteringskanaal waar vast afval verzameld en het lichaam verlaat?
- Goedkopere waterstofbrandstofcel kan betere groene energie-opties betekenen

- Onderzoekers synthetiseren halfmetaal zonder magnetisatie
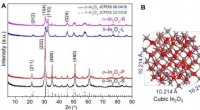
- Efficiënte indiumoxidekatalysatoren ontworpen voor CO2-hydrogenering tot methanol
- Zo ontdek je snel nieuwe materialen

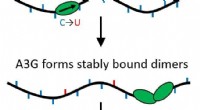
- Een als door te bewerken, twee als door wegversperring:menselijk eiwit bestrijdt HIV als monomeer en dimeer
 Wereld ziet snelle stijging van extreem weer:rapport
Wereld ziet snelle stijging van extreem weer:rapport Nieuw onderzoek laat zien hoe aandachtstekorten worden uitgebuit door nepnieuwssites
Nieuw onderzoek laat zien hoe aandachtstekorten worden uitgebuit door nepnieuwssites  Een theorie dat het universum begon in een gigantische explosie?
Een theorie dat het universum begon in een gigantische explosie?  Welk element heeft een elektronenrangschikking van 2882?
Welk element heeft een elektronenrangschikking van 2882?  Hoe lagers werken
Hoe lagers werken  Wetenschappers passen twee co-katalysatoren op één nanosheet voor een betere waterzuivering
Wetenschappers passen twee co-katalysatoren op één nanosheet voor een betere waterzuivering Wat zijn enkele attracties over Pluto?
Wat zijn enkele attracties over Pluto?  New Horizons-wetenschappers verbaasd over het ontbreken van een lichtcurve van hun doel in de Kuipergordel
New Horizons-wetenschappers verbaasd over het ontbreken van een lichtcurve van hun doel in de Kuipergordel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

