
Wetenschap
Sommige stoffen verdampen gemakkelijker dan andere omdat ze?
* intermoleculaire krachten: Dit zijn de aantrekkelijke krachten tussen moleculen. Ze houden moleculen bij elkaar in vloeibare of vaste toestand.
* Verdamping: Verdamping treedt op wanneer moleculen aan het oppervlak van een vloeistof voldoende energie krijgen om de intermoleculaire krachten te overwinnen die ze in de vloeibare toestand houden en in de gasfase ontsnappen.
Soorten intermoleculaire krachten (van zwakste tot sterkste):
* Dispersietroepen in Londen: Aanwezig in alle moleculen. Ze worden veroorzaakt door tijdelijke schommelingen in elektronenverdeling.
* Dipole-Dipole Forces: Komen tussen poolmoleculen op. Deze krachten zijn sterker dan de dispersietroepen in Londen.
* waterstofbinding: Een speciaal type dipool-dipoolinteractie waarbij een waterstofatoom betrokken is gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor). Dit zijn de sterkste intermoleculaire krachten.
Hier is de verbinding:
* Zwakke intermoleculaire krachten: Moleculen met zwakke intermoleculaire krachten vereisen minder energie om deze krachten te overwinnen en te ontsnappen in de gasfase. Dit leidt tot hogere verdampingspercentages.
* Sterke intermoleculaire krachten: Moleculen met sterke intermoleculaire krachten vereisen meer energie om deze krachten te overwinnen en te verdampen. Dit leidt tot lagere verdampingspercentages.
Voorbeelden:
* Water: Heeft sterke waterstofbinding, waardoor het relatief moeilijk is om te verdampen.
* aceton: Heeft zwakkere dipool-dipoolkrachten en disperstroepen in Londen, waardoor het gemakkelijk verdampt.
Samenvattend: De sterkte van de intermoleculaire krachten tussen moleculen beïnvloedt direct hoe gemakkelijk een stof verdampt. Zwakkere krachten betekenen gemakkelijker verdamping.
 Hoe heeft papier effect op de samenleving?
Hoe heeft papier effect op de samenleving?  Expeditie naar Peru legt klimaatgeschiedenis vast in ijs - voordat het weg is
Expeditie naar Peru legt klimaatgeschiedenis vast in ijs - voordat het weg is Waar heb je dat geweldige idee vandaan? Team zoekt de bron van creativiteit:dichtbij of veraf?
Waar heb je dat geweldige idee vandaan? Team zoekt de bron van creativiteit:dichtbij of veraf?  Invasieve tropische plant kan metaalverontreinigende stoffen volledig uit de Britse rivieren verwijderen - nieuwe studie
Invasieve tropische plant kan metaalverontreinigende stoffen volledig uit de Britse rivieren verwijderen - nieuwe studie Wat is de relatie tussen aardwetenschappen en natuurwetenschappen?
Wat is de relatie tussen aardwetenschappen en natuurwetenschappen?
Hoofdlijnen
- Verschillende diëten van bonobogroepen kunnen inzicht bieden in de manier waarop cultuur tot stand komt
- Wat is het mechanisme waarmee organismen kunnen evolueren?
- Wat is de relatie tussen kankercellen en een tumor?
- Welke categorie bevat de meeste organismen?
- Waar vind je DNA- en erfelijkheidsinformatie voor de cel?
- Wat zijn de 3 belangrijkste delen van een cel?
- Hoe verstoppen bacteriën medische apparaten? Zeer snel
- De opwarming van de aarde kan de leefgebieden van muggen een impuls geven, zo blijkt uit onderzoek
- Wat is hetzelfde aan eukaryotische cellen en prokaryotische cellen?
- Nieuwe technologie zet afvalplastic in een uur om in vliegtuigbrandstof

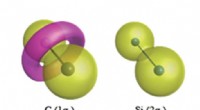
- Kernelektrontopologieën in chemische binding
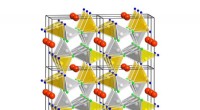
- Een nieuwe energiebesparende LED-fosfor
- Nieuwe strategie voor afgifte van therapeutische eiwitten kan helpen bij de behandeling van degeneratieve oogziekten
- Power dressing:Elektriciteitsgenererend, rekbaar, zelfherstellende materialen voor wearables

 Is Earth Science vergelijkbaar met de milieuwetenschap?
Is Earth Science vergelijkbaar met de milieuwetenschap?  Welke planeet is 3670 miljoen mijl van de zon?
Welke planeet is 3670 miljoen mijl van de zon?  Contrafeiten gebruiken om voorspellingen over de veiligheid van geneesmiddelen te verifiëren
Contrafeiten gebruiken om voorspellingen over de veiligheid van geneesmiddelen te verifiëren Hubbles-verhaal over twee exoplaneten:natuur versus opvoeding
Hubbles-verhaal over twee exoplaneten:natuur versus opvoeding Genetische geschiedenis:op zoek naar de Afrikaanse wortels van Noir Marron-gemeenschappen
Genetische geschiedenis:op zoek naar de Afrikaanse wortels van Noir Marron-gemeenschappen Nieuwe synthesemethode opent mogelijkheden voor organische elektronica
Nieuwe synthesemethode opent mogelijkheden voor organische elektronica Welke factoren bepalen de kracht van een vulkaanuitbarsting?
Welke factoren bepalen de kracht van een vulkaanuitbarsting?  Wat betekent "Investeren" met tropisch weer?
Wat betekent "Investeren" met tropisch weer?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

