
Wetenschap
Wat hebben fluor en chloor gemeen?
* zeer reactieve niet -metalen: Beide zijn zeer reactieve niet -metalen, die gemakkelijk negatieve ionen (anionen) vormen door een elektron te winnen. Deze reactiviteit is te wijten aan hun hoge elektronegativiteit en een sterke neiging om een stabiele octetconfiguratie te bereiken.
* Diatomaire moleculen vormen: Beide bestaan als diatomaire moleculen in hun elementaire vorm (F₂ en CL₂), vanwege de sterke covalente binding tussen twee atomen van hetzelfde element.
* Soortgelijke chemische eigenschappen: Ze vertonen vergelijkbare chemische eigenschappen, waaronder het vormen van vergelijkbare soorten verbindingen (bijv. Haliden).
* Beide hebben zeven valentie -elektronen: Beide hebben zeven elektronen in hun buitenste energieschil (valentie -elektronen), waardoor ze zeer elektronegatief zijn en vatbaar zijn voor het vormen van ionische bindingen.
* Oxidatie stelt: Zowel fluor als chloor kunnen oxidatietoestanden vertonen variërend van -1 tot +7, maar fluor wordt altijd gevonden in de -1 oxidatietoestand vanwege de hoge elektronegativiteit.
Er zijn echter enkele belangrijke verschillen:
* Reactiviteit: Fluor is het meest reactieve element, terwijl chloor minder reactief is.
* Kook- en smeltpunten: Chloor heeft een hoger smelt- en kookpunt dan fluor als gevolg van sterkere intermoleculaire krachten tussen chloormoleculen.
* uiterlijk: Chloor is een geelgroen gas bij kamertemperatuur, terwijl fluor een lichtgeel gas is.
Samenvattend delen fluor en chloor significante overeenkomsten als halogenen, maar vertonen ook verschillende verschillen in hun reactiviteit, fysische eigenschappen en uiterlijk.
 Leg uit waarom de brekingsindex voor lucht (een gas) kleiner is dan een vaste zoals glas?
Leg uit waarom de brekingsindex voor lucht (een gas) kleiner is dan een vaste zoals glas?  Wat is pH van 50 procent oplossing Natriumhydroxide en water?
Wat is pH van 50 procent oplossing Natriumhydroxide en water?  Onderzoekers ontwikkelen een zeer efficiënt kooldioxide-elektroreductiesysteem om de CO2-voetafdruk te verkleinen
Onderzoekers ontwikkelen een zeer efficiënt kooldioxide-elektroreductiesysteem om de CO2-voetafdruk te verkleinen  Wat is de oplosbaarheid van lipiden in ether?
Wat is de oplosbaarheid van lipiden in ether?  Ingenieurs leggen uit waarom de huid bestand is tegen scheuren
Ingenieurs leggen uit waarom de huid bestand is tegen scheuren
 De bodem is onze beste bondgenoot in de strijd tegen klimaatverandering, maar raakte snel uitgeput
De bodem is onze beste bondgenoot in de strijd tegen klimaatverandering, maar raakte snel uitgeput Welke praktijken naast de wetenschap worden onder wereldculturen gebruikt om te leren over de natuurlijke wereld?
Welke praktijken naast de wetenschap worden onder wereldculturen gebruikt om te leren over de natuurlijke wereld?  Megalodon Feiten voor kinderen
Megalodon Feiten voor kinderen  Beneden en vies:afvalwater van varkensboerderijen in Okinawa reinigen met microbiële brandstofcellen
Beneden en vies:afvalwater van varkensboerderijen in Okinawa reinigen met microbiële brandstofcellen Wat beschrijft bosbodem het beste?
Wat beschrijft bosbodem het beste?
Hoofdlijnen
- Bestaat er een verband tussen intelligentie en psychische aandoeningen?
- Vermeld de drie delen van de celtheorie en beschrijf kort hoe het zich met u verhoudt?
- Make-up en wetenschap Eerlijke ideeën
- Een nieuwe kijk op toerisme en zijn bijdrage aan natuurbehoud in Nieuw-Zeeland
- Wat is een Syonyum?
- Wie ben ik de wetenschapper die concludeerde dat alle planten uit cellen bestaan?
- Onderzoekers ontdekken dat een klein organisme de kracht heeft om een hardnekkig broeikasgas op landbouwvelden te verminderen
- Hoe verzamelen wetenschappers gegevens?
- Kwakzalvermedicijnen, insectenimmigranten en wat er eet tussen geheimen onthuld door DNA-barcodes
- Een groenere route naar blauw:nieuwe methode vermindert drastisch de hoeveelheid oplosmiddel die nodig is om organische kleurstoffen te produceren

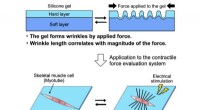
- Wetenschappers ontwikkelen directe meting voor kracht van skeletspiermyotubes
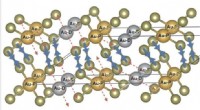
- Wetenschappers lossen de gouden puzzel van calaveriet op
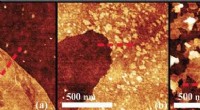
- Fout gevonden in waterbehandelingsmethode:het proces kan onbewust schadelijke chemicaliën genereren

- Verbeterd begrip van baanbrekende vloeibaar-metaal 2D-techniek
 Open dataset van menselijke navigatiestrategieën in buitenlandse netwerksystemen
Open dataset van menselijke navigatiestrategieën in buitenlandse netwerksystemen Wie zoomt wie? Hoe de coronaviruscrisis eindelijk het sociale in sociale media brengt
Wie zoomt wie? Hoe de coronaviruscrisis eindelijk het sociale in sociale media brengt Welk type rots wordt gevormd als andere rotsen door intense hitte en druk doorlopen, maar niet smelten?
Welk type rots wordt gevormd als andere rotsen door intense hitte en druk doorlopen, maar niet smelten?  Hoe worden erfelijke ziekten behandeld?
Hoe worden erfelijke ziekten behandeld?  Hoe lang gaat de Hubble -telescoop worden gebruikt?
Hoe lang gaat de Hubble -telescoop worden gebruikt?  Lichtere voertuigen maken met magnesiumlegeringen
Lichtere voertuigen maken met magnesiumlegeringen Welk spectrale type ster die nog steeds het meest recent is gevormd?
Welk spectrale type ster die nog steeds het meest recent is gevormd?  Hoe benad je kosmische energie door kristallen?
Hoe benad je kosmische energie door kristallen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

