
Wetenschap
Bij welke temperatuur begint een geconcentreerde waterige oplossing van natriumchloride te koken?
* Kookpunthoogte: Het toevoegen van een opgeloste stof (zoals zout) aan een oplosmiddel (zoals water) verhoogt het kookpunt van de oplossing. Dit wordt kookpunthoogte genoemd.
* concentratie is belangrijk: Hoe meer opgeloste stof u toevoegt, hoe hoger de hoogte van het kookpunt. Een geconcentreerde oplossing zal een hoger kookpunt hebben dan een verdunde oplossing.
om het kookpunt te bepalen:
1. U hebt de concentratie nodig: De concentratie van de natriumchloride -oplossing moet worden gespecificeerd, meestal in termen van molariteit, molaliteit of percentage per massa.
2. Gebruik de hoogteformule van het kookpunt: Het kookpunthoogte wordt berekend met behulp van de formule:
Δt =kb * m
Waar:
* Δt =verandering in kookpunt
* KB =Ebullioscopische constante voor water (0,512 ° C/m)
* m =molaliteit van de oplossing (mol opgeloste stof per kg oplosmiddel)
Voorbeeld:
Laten we zeggen dat u een 1 molale (1 m) oplossing van NaCl hebt.
* Δt =(0,512 ° C/m) * (1 m) =0,512 ° C
Omdat het normale kookpunt van zuiver water 100 ° C is, zou het kookpunt van deze 1 m NaCl -oplossing ongeveer 100.512 ° C zijn.
Conclusie: U moet de specifieke concentratie van de natriumchloride -oplossing kennen om het kookpunt te berekenen.
 Op tandwielen gebaseerde mechanische metamaterialen maken het mogelijk om configureerbare bladen te maken
Op tandwielen gebaseerde mechanische metamaterialen maken het mogelijk om configureerbare bladen te maken Wat zijn de reactieproducten tussen antimoontrioxide en water?
Wat zijn de reactieproducten tussen antimoontrioxide en water?  Wat is langzaam bindende kinetiek?
Wat is langzaam bindende kinetiek?  Wat is de fysieke staat van fluor op 25 graden?
Wat is de fysieke staat van fluor op 25 graden?  Waarom hebben alle elementen in een groep vergelijkbare fysische en chemische eigenschappen?
Waarom hebben alle elementen in een groep vergelijkbare fysische en chemische eigenschappen?
Hoofdlijnen
- Welke bloedcel is voorouderlijk van bloedplaatjes?
- Wat wordt bedoeld met fenotype plasticiteit in wortels en scheuten?
- Welk proces gebruikt zuurstof in plantenalgen en dieren?
- Wat is een relatie waarin twee verschillende organismen nauwe associatie met elkaar leven?
- Wat breekt een dubbele DNA-helix uiteen?
- Wetenschappers ontdekken pad naar verbeterde gerstkwaliteit
- Hoeveel chromosomen zitten er in een shiitake -paddestoelcel?
- Heeft de vroege stijging van het zuurstofgehalte op aarde de evolutie van meercellig leven ondersteund – of onderdrukt?
- Dierlijke versus plantencellen: overeenkomsten en verschillen (met grafiek)
- Identificatie van een ongrijpbaar molecuul dat de sleutel is tot verbrandingschemie
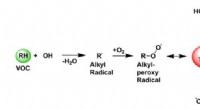
- Externe structuur kan de functie van enzymen beïnvloeden

- Wetenschappers creëren een nieuw type intelligent materiaal

- Onderzoekers pionieren met machine learning om chemische ontdekkingen te versnellen, afval verminderen

- Een elektrische benadering met één molecuul voor aminozuurdetectie en chiraliteitsherkenning
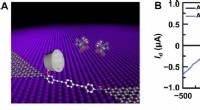
 Wat is een groter zonnestelsel of melkachtige manier?
Wat is een groter zonnestelsel of melkachtige manier?  Kan elk land een Green New Deal hebben? Stanford-rapport brengt paden in kaart voor 143 landen
Kan elk land een Green New Deal hebben? Stanford-rapport brengt paden in kaart voor 143 landen Aanstaande asteroïdemissies kunnen onze oorsprong onthullen, en help de aarde te redden van een dodelijke aanval
Aanstaande asteroïdemissies kunnen onze oorsprong onthullen, en help de aarde te redden van een dodelijke aanval Wat is een voorbeeld van een variatie die individueel voordeel kan geven voor het overleven en het produceren van nakomelingen?
Wat is een voorbeeld van een variatie die individueel voordeel kan geven voor het overleven en het produceren van nakomelingen?  Wetgever uit Massachusetts wil officiële staatsdinosaurus noemen
Wetgever uit Massachusetts wil officiële staatsdinosaurus noemen Wat is het voorbeeld van ionische binding?
Wat is het voorbeeld van ionische binding?  Wat is de temperatuur van een zwarte dwergster?
Wat is de temperatuur van een zwarte dwergster?  Luisteren naar signalen die door bruggen reizen om schade te diagnosticeren
Luisteren naar signalen die door bruggen reizen om schade te diagnosticeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

