
Wetenschap
Wat is het voorbeeld van ionische binding?
eenvoudige voorbeelden:
* Natriumchloride (NaCl) - Tafelzout: Natrium (NA) is een metaal dat gemakkelijk een elektron verliest om een positief geladen ion te worden (Na+). Chloor (CL) is een niet-metaal dat een elektron krijgt om een negatief geladen ion te worden (Cl-). De tegenovergestelde ladingen trekken aan en vormen een sterke ionische binding.
* kaliumbromide (KBR): Net als natriumchloride verliest kalium (K) een elektron om K+ te worden en broom (BR) krijgt een elektron om Br- te worden.
* magnesiumoxide (MGO): Magnesium (mg) verliest twee elektronen om mg2+ te worden en zuurstof (O) krijgt twee elektronen om O2- te worden.
Meer complexe voorbeelden:
* calciumcarbonaat (caco3): Calcium (CA) verliest twee elektronen om Ca2+te worden. Het carbonaation (CO3) 2- heeft een 2-lading. Dit vormt een sterke ionische binding.
* Natriumsulfaat (Na2SO4): Twee natriumatomen (Na+) binden met één sulfaation (SO4) 2-.
* aluminiumoxide (AL2O3): Twee aluminiumatomen (AL3+) binden met drie zuurstofatomen (O2-).
belangrijke opmerkingen:
* metalen en niet -metalen: Ionische bindingen treden meestal op tussen metalen en niet -metalen. Metalen verliezen de neiging elektronen te verliezen, die positieve ionen (kationen) vormen, terwijl niet -metalen de neiging hebben elektronen te krijgen, die negatieve ionen (anionen) vormen.
* Elektrostatische aantrekkingskracht: Het belangrijkste kenmerk van ionische bindingen is de sterke elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen.
* kristallijne structuren: Ionische verbindingen vormen meestal kristallijne structuren vanwege de geordende opstelling van ionen.
* Hoog smelten- en kookpunten: Ionische bindingen zijn erg sterk, wat resulteert in hoge smelt- en kookpunten voor ionische verbindingen.
* Oplosbaarheid in water: Veel ionische verbindingen lossen op in water omdat watermoleculen kunnen interageren met en de ionen kunnen scheiden.
Laat het me weten als je meer voorbeelden wilt of specifieke eigenschappen van ionische verbindingen wilt verkennen!
 De natuur laat zien hoe bacteriën lignine afbreken en geeft een beter inzicht in het maken van biobrandstoffen
De natuur laat zien hoe bacteriën lignine afbreken en geeft een beter inzicht in het maken van biobrandstoffen  Zo ziet een rekbaar circuit eruit
Zo ziet een rekbaar circuit eruit Is het waar dat chemische reacties moleculen en verbindingen creëren?
Is het waar dat chemische reacties moleculen en verbindingen creëren?  Wat is het totale reductiepotentieel van een cel waarin lithium (Li) reduceert en kwik (Hg) oxideert?
Wat is het totale reductiepotentieel van een cel waarin lithium (Li) reduceert en kwik (Hg) oxideert?  Welke mineralen zijn er in zout?
Welke mineralen zijn er in zout?
 Onderzoek zegt dat steden in India rekening moeten houden met extreme regenval bij het plannen van nieuwe infrastructuur
Onderzoek zegt dat steden in India rekening moeten houden met extreme regenval bij het plannen van nieuwe infrastructuur Grote westerse merken vervuilen oceanen met goedkoop plastic in Filipijnen:rapport
Grote westerse merken vervuilen oceanen met goedkoop plastic in Filipijnen:rapport Een handdoek minder:hoe psychologen gezelligheid benutten om verspilling tegen te gaan
Een handdoek minder:hoe psychologen gezelligheid benutten om verspilling tegen te gaan  Duitsland geeft toe dat het de klimaatdoelstelling voor 2020 ver achterblijft
Duitsland geeft toe dat het de klimaatdoelstelling voor 2020 ver achterblijft Wat veroorzaakt barometrische druk?
Wat veroorzaakt barometrische druk?
Hoofdlijnen
- Welk enzym voegt nucleïnezuren toe aan de DNA-keten?
- Waarom is de pH een belangrijke kwestie van de biologie?
- Wat veroorzaakt verkoudheid?
- Zou je eiwitten in cellen of eiwitten vinden?
- Welke RNA- en DNA -nucleotiden zijn purines?
- Waarom is hypothese belangrijk in de wetenschap?
- Onderzoek creëert een manier om varkens te beschermen tegen PRRS tijdens de voortplanting
- Waar bevindt het cytoplasma zich op een dierencel?
- Waarom is de studie van de histologie belangrijk in uw algehele begrip van anatomie en fysiologie?
- Supercomputing van de opkomst van materieel gedrag
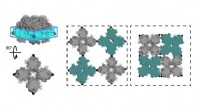
- Onderzoekers ontcijferen structuur van veelbelovende metalen organische raamwerken

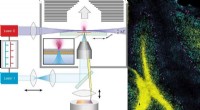
- Innovatieve methode geeft uniek inzicht in de structuur van cellen en weefsels
- Zeer efficiënt, duurzame elektrokatalysator om de productie van waterstofbrandstof te stimuleren

- Krakende ontdekking:Japanse wetenschapper gebruikt eiwit voor schone energie

 Gadgets:slimme tags helpen je georganiseerd te blijven
Gadgets:slimme tags helpen je georganiseerd te blijven Tekenen van verzadiging komen voort uit deeltjesbotsingen bij RHIC
Tekenen van verzadiging komen voort uit deeltjesbotsingen bij RHIC Onderwater vulkaangedrag vastgelegd door tijdige wetenschappelijke expeditie
Onderwater vulkaangedrag vastgelegd door tijdige wetenschappelijke expeditie Welke energieoverdracht veroorzaakt de meeste warmte?
Welke energieoverdracht veroorzaakt de meeste warmte?  Online winkelen? Manieren om schade aan het milieu te verminderen
Online winkelen? Manieren om schade aan het milieu te verminderen 10 geweldige nieuwe uitvindingen waar je nog nooit van zult horen
10 geweldige nieuwe uitvindingen waar je nog nooit van zult horen  Investeer in groene ruimte om het welzijn in steden te vergroten, zeggen onderzoekers
Investeer in groene ruimte om het welzijn in steden te vergroten, zeggen onderzoekers Wat is de vergelijking voor N2O?
Wat is de vergelijking voor N2O?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

