
Wetenschap
Wat is de chemische eigenschap van fluor?
Key Properties:
* Hoge elektronegativiteit: Fluor heeft de hoogste elektronegativiteit van alle elementen, wat betekent dat het elektronen sterk in een binding aantrekt. Dit maakt het een zeer reactief oxidatiemiddel.
* Strong oxidatiemiddel: Fluor krijgt gemakkelijk elektronen en veroorzaakt oxidatiereacties. Het kan de meeste andere elementen oxideren, zelfs edelgassen zoals Xenon en Krypton.
* zeer reactief: Het reageert met bijna alle elementen, vaak explosief, waardoor sterke banden met hen worden gevormd.
* kleurloos gas: In zijn elementaire vorm is fluor een lichtgeel, sterk corrosief gas bij kamertemperatuur.
* Strong reductiemiddel: Het kan in sommige gevallen als een reductiemiddel fungeren, vooral bij het reageren met krachtige oxiderende middelen.
* vormt sterke bindingen: Fluor vormt sterke enkele bindingen, vooral met koolstof, en daarom wordt het veel gebruikt bij de synthese van veel verbindingen.
* vormt stabiele anionen: Fluor vormt gemakkelijk het fluoride-anion (F-), dat een stabiel, kleurloos en sterk oplosbaar ion is.
* unieke eigenschappen in verbindingen: Fluor's aanwezigheid in verbindingen geeft vaak unieke eigenschappen, zoals verhoogde zuurgraad, verhoogde reactiviteit en verbeterde stabiliteit.
belangrijke toepassingen:
* Fluorchemie: Fluor wordt gebruikt bij de productie van een breed scala aan gefluoreerde verbindingen, waaronder:
* Polytetrluorethyleen (PTFE) , bekend als Teflon, een antiaanbaklaag die in veel toepassingen wordt gebruikt.
* Koelmiddelen: Fluor-bevattende koelmiddelen zoals Freon worden gebruikt in koelsystemen.
* Pharmaceuticals: Fluor wordt gebruikt bij de synthese van veel geneesmiddelen, waaronder antidepressiva, ontstekingsremmende middelen en antivirale middelen.
* Industriële chemicaliën: Fluor wordt gebruikt bij de productie van verschillende industriële chemicaliën, waaronder katalysatoren en oplosmiddelen.
Veiligheidsproblemen:
* Zeer giftig: Fluorgas is extreem giftig en kan ernstige brandwonden veroorzaken.
* corrosief: Het is ook corrosief voor de meeste materialen, inclusief glas en metalen.
Samenvattend:
Fluor is een zeer reactief, elektronegatief element met een krachtige oxiderende aard. De unieke eigenschappen hebben geleid tot zijn wijdverbreide gebruik op verschillende gebieden, waaronder chemie, geneeskunde en industrie. De reactiviteit en toxiciteit ervan vereisen echter zorgvuldige handling- en veiligheidsmaatregelen.
 Welke krachten tussen watermoleculen zijn verantwoordelijk voor veel ongebruikelijke fysische eigenschappen?
Welke krachten tussen watermoleculen zijn verantwoordelijk voor veel ongebruikelijke fysische eigenschappen?  Helder en sterk:een materiaal dat zichzelf geneest en gloeit
Helder en sterk:een materiaal dat zichzelf geneest en gloeit  Wat is chemische naam voor HN?
Wat is chemische naam voor HN?  Kunstmatige intelligentie heeft geleerd om olieviscositeit in te schatten
Kunstmatige intelligentie heeft geleerd om olieviscositeit in te schatten Grote organische moleculen worden gewoonlijk samengesteld door polymerisatie van een paar soorten waarbij eenvoudige subeenheden worden herhaald. Wat is een uitzondering op deze bewering?
Grote organische moleculen worden gewoonlijk samengesteld door polymerisatie van een paar soorten waarbij eenvoudige subeenheden worden herhaald. Wat is een uitzondering op deze bewering?
 5 groene technologieën voor interplanetaire ruimtevaart
5 groene technologieën voor interplanetaire ruimtevaart  Hoe kan klimaatverandering of effect plantendiversiteit?
Hoe kan klimaatverandering of effect plantendiversiteit?  Hoe beïnvloedt het klimaat het ecosysteem van het regenwoud?
Hoe beïnvloedt het klimaat het ecosysteem van het regenwoud?  Afbeelding:Waarom sprinkhanen de boerderijen van Alberta teisteren
Afbeelding:Waarom sprinkhanen de boerderijen van Alberta teisteren  Modderige wateren:zinkende organische stoffen veranderen zeebodemrecords
Modderige wateren:zinkende organische stoffen veranderen zeebodemrecords
Hoofdlijnen
- Wat zijn enkele voorbeelden van aaseters in een zoetwaterbioom?
- Wat is de juiste getranscribeerde RNA -streng voor DNA AGC CAA ATG?
- Wat voor soort organisme zet stikstof om in een bruikbare vormplanten?
- Hoe vindt selectief fokken plaats?
- Wat voor soort stengel zit er in een neemplant?
- Dezelfde soorten cellen die groeien in vergelijkbare patronen die verschillende maar gerelateerde organismen produceren?
- Wat voor soort wetenschapper bestudeert de interacties tussen levensvormen en milieu?
- Wat bevat celsap?
- Wat is een gelijkenis tussen haploïde en diploïde?
- Kunstmatige fotosynthese zet koolstofdioxide om in vloeibare brandstoffen
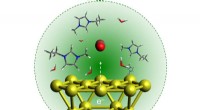
- Synthetische verbinding zorgt voor snelle screening op potentiële medicijnen
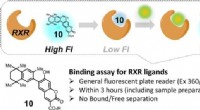
- Onderzoekers ontwikkelen sterkere microben om de bioproductie van brandstoffen te verbeteren, Chemicaliën
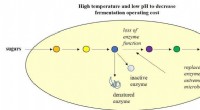
- Wetenschappers ontwikkelen breedspectrumremmers van het griepvirus
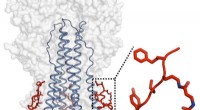
- Hybride fotoactieve perovskieten voor het eerst gefotografeerd met atomaire resolutie

 Wat doet een massaspectrometer?
Wat doet een massaspectrometer?  Wat gebeurt er als mitose fout gaat en in welke fase gaat het fout?
Wat gebeurt er als mitose fout gaat en in welke fase gaat het fout?
De meeste cellen groeien en delen voortdurend. Een proces dat de celcyclus wordt genoemd, laat een cel groeien, zijn DNA dupliceren en delen. Celdeling gebeurt via een ander proc
 Wat is de druk in een ballon van 0,34 L als temperatuur 35 ° C en 0,0233 mol een ideaal gas bevat?
Wat is de druk in een ballon van 0,34 L als temperatuur 35 ° C en 0,0233 mol een ideaal gas bevat?  Onderdompelingsmetalen lenzen op zichtbare golflengten voor beeldvorming op nanoschaal
Onderdompelingsmetalen lenzen op zichtbare golflengten voor beeldvorming op nanoschaal Onderzoekers demonstreren continue laserwerking in apparaten gemaakt van perovskietmaterialen
Onderzoekers demonstreren continue laserwerking in apparaten gemaakt van perovskietmaterialen Onder de oppervlakte kijken - steden leefbaarder maken
Onder de oppervlakte kijken - steden leefbaarder maken Onderzoeksteam streeft ernaar de kosten van medicijnontwikkeling te verlagen met behulp van 3D-geprinte levende weefsels
Onderzoeksteam streeft ernaar de kosten van medicijnontwikkeling te verlagen met behulp van 3D-geprinte levende weefsels Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

