
Wetenschap
Wat is de druk in een ballon van 0,34 L als temperatuur 35 ° C en 0,0233 mol een ideaal gas bevat?
1. Converteren eenheden
* Temperatuur (Celsius tot Kelvin): T (k) =t (° C) + 273.15
Dus 35 ° C =35 + 273.15 =308.15 K
* volume (liters tot kubieke meter): 1 l =0,001 m³
Dus 0,34 L =0,34 * 0,001 m³ =0,00034 m³
2. Gebruik de ideale gaswet
De ideale gaswet is:PV =NRT
waar:
* P =druk (pa)
* V =volume (m³)
* n =aantal mol
* R =ideale gasconstante (8.314 J/mol · k)
* T =temperatuur (k)
3. Oplossen voor druk
Herschik de ideale gaswet om op te lossen voor druk:
P =(nrt) / v
4. Vervang waarden
P =(0,0233 mol * 8.314 j / mol · k * 308.15 k) / 0,00034 m³
5. Berekenen
P ≈ 1.76 x 10⁵ PA
Daarom is de druk in de ballon ongeveer 1,76 x 10⁵ Pascals.
 Een duidelijker beeld van hoe ijzer reageert in de omgeving
Een duidelijker beeld van hoe ijzer reageert in de omgeving  Waarom water gebruikt bij methylethanoaathydrolyse?
Waarom water gebruikt bij methylethanoaathydrolyse?  Hoe zich te ontdoen van statische hechting op Office
Hoe zich te ontdoen van statische hechting op Office Wanneer een verbinding als een elektronenacceptor dient, wordt deze geoxideerd?
Wanneer een verbinding als een elektronenacceptor dient, wordt deze geoxideerd?  Wat is de netto ionische vergelijking voor bariumhydroxide plus broomwaterstofzuur?
Wat is de netto ionische vergelijking voor bariumhydroxide plus broomwaterstofzuur?
 Veerkracht tegen klimaatverandering? Uit nieuw onderzoek blijkt dat octopussen zich aanpassen aan hogere zuurniveaus in de oceaan
Veerkracht tegen klimaatverandering? Uit nieuw onderzoek blijkt dat octopussen zich aanpassen aan hogere zuurniveaus in de oceaan  Koralen overleven om het verhaal van de nieuwste eilanduitbarsting van de aarde te vertellen
Koralen overleven om het verhaal van de nieuwste eilanduitbarsting van de aarde te vertellen Hoe worden soorten gesorteerd in de verschillende koninkrijken?
Hoe worden soorten gesorteerd in de verschillende koninkrijken?  Hoe helpt fotosynthese bomen te groeien?
Hoe helpt fotosynthese bomen te groeien?  Gezondheidswaarschuwingen en snelheidslimieten terwijl Europa in een hittegolf raast
Gezondheidswaarschuwingen en snelheidslimieten terwijl Europa in een hittegolf raast
Hoofdlijnen
- Sperma zijn, of niet sperma? Ontdekking van een genetische schakelaar die het lot van kiemcellen bepaalt
- Organismen waarvan het domein de omgevingen bezetten die het dichtst bij die primitieve aarde staan. A. Archaea b. Eukarya c. Eubacteria d. Organismen uit alle domeinen zijn te vinden in gebieden?
- Op welke manieren zijn de bloemen vergelijkbaar met het reproductieve systeem van dieren?
- Wat is landbouwbiotechnologie?
- Symbiose en celevolutie:Lynn Margulis en de oorsprong van eukaryoten
- Wat u moet weten over mitose voor een test
- Verschillende soorten brood Mold
- Wat is de fysieke expressie van een allel?
- Hoe wordt het proces genoemd waarin culturen meer en lijken op elkaar worden?
- Snellere luchtverversing in gebouwen niet altijd gunstig voor coronavirusniveaus

- Quantum snelheidslimieten zijn niet echt kwantum

- Onderzoekers onderzoeken de implicaties van overmatige waterstofbinding op het ijs-damp-grensvlak

- Waarom ruis de gevoeligheid voor zwakke signalen kan vergroten?
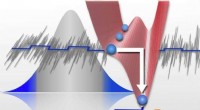
- Vlindereffect kan de reis van met virus beladen druppeltjes verdubbelen
 Ga je duiken in de tropen? eet de rifvissen niet!
Ga je duiken in de tropen? eet de rifvissen niet! Welke invloed zullen slimme auto’s hebben op de toekomst van autorijden?
Welke invloed zullen slimme auto’s hebben op de toekomst van autorijden?  NASA en Sierra Space leveren het Dream Chaser-ruimtevliegtuig af aan Florida ter voorbereiding op de lancering
NASA en Sierra Space leveren het Dream Chaser-ruimtevliegtuig af aan Florida ter voorbereiding op de lancering  REIZEN LICHTGOLVEN SNELLER DAN GELUIDGOLVEN?
REIZEN LICHTGOLVEN SNELLER DAN GELUIDGOLVEN?  Wetenschappers krijgen meer inzicht in de manier waarop belangrijke hormonen in cellen werken
Wetenschappers krijgen meer inzicht in de manier waarop belangrijke hormonen in cellen werken  Hoe schrijf je een chemische vergelijking waarbij magnesium reageert met ijzerIII-nitraatoplossing om ijzer en oplossing te vormen?
Hoe schrijf je een chemische vergelijking waarbij magnesium reageert met ijzerIII-nitraatoplossing om ijzer en oplossing te vormen?  Een nieuw kandidaatmateriaal voor kwantumspinvloeistoffen
Een nieuw kandidaatmateriaal voor kwantumspinvloeistoffen Studie vindt bewijs dat nanodeeltjes de DNA-schade van planten kunnen vergroten
Studie vindt bewijs dat nanodeeltjes de DNA-schade van planten kunnen vergroten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

