
Wetenschap
Welk volume zuurstof bij STPI's nodig om te reageren met 1,50 mol C2H4?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie tussen ethene (c₂h₄) en zuurstof (o₂) produceert koolstofdioxide (co₂) en water (h₂o):
C₂h₄ + 3o₂ → 2co₂ + 2h₂o
2. Bepaal de molverhouding:
Uit de evenwichtige vergelijking zien we dat 1 mol C₂h₄ reageert met 3 mol O₂.
3. Bereken de mol O₂ nodig:
Omdat we 1,50 mol C₂h₄ hebben, hebben we nodig:
1,50 mol C₂h₄ × (3 mol o₂ / 1 mol c₂h₄) =4,50 mol o₂
4. Pas de ideale gaswet toe:
Bij STP (standaardtemperatuur en druk):
* Temperatuur (t) =273,15 K
* Druk (p) =1 atm
* Ideale gasconstante (r) =0,0821 l · atm/mol · k
De ideale gaswet is:PV =NRT
We kunnen dit herschikken om op te lossen voor volume (v):
V =nrt / p
5. Bereken het volume van O₂:
V =(4,50 mol) (0,0821 l · atm / mol · k) (273,15 k) / (1 atm)
V ≈ 101 l
Daarom heeft u ongeveer 101 liter zuurstof nodig bij STP om te reageren met 1,50 mol ethene.
 Geometrie-adaptieve elektrokatalyse:de voorgestelde aanpak zou de efficiëntie van energieconversietechnologieën kunnen verdubbelen
Geometrie-adaptieve elektrokatalyse:de voorgestelde aanpak zou de efficiëntie van energieconversietechnologieën kunnen verdubbelen  Wat is de vergelijking van ammoniumcarbonaat en kaliumhydroxide?
Wat is de vergelijking van ammoniumcarbonaat en kaliumhydroxide?  Een fullereenachtig molecuul dat volledig uit metaalatomen bestaat
Een fullereenachtig molecuul dat volledig uit metaalatomen bestaat  Is een magalyst van magnesiummetalen?
Is een magalyst van magnesiummetalen?  Welke temperatuur is verzadiging bereikt?
Welke temperatuur is verzadiging bereikt?
 Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti
Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti Eet je hart uit:inheemse waterratten hebben ontdekt hoe ze veilig rietpadden kunnen eten
Eet je hart uit:inheemse waterratten hebben ontdekt hoe ze veilig rietpadden kunnen eten  Onderzoekers meten fotosynthese vanuit de ruimte
Onderzoekers meten fotosynthese vanuit de ruimte VN:68 procent van de wereldbevolking zal in 2050 in stedelijke gebieden wonen
VN:68 procent van de wereldbevolking zal in 2050 in stedelijke gebieden wonen Feiten voor kinderen: regenwouddieren
Feiten voor kinderen: regenwouddieren
Hoofdlijnen
- Waar en hoe een eatherquake optreedt?
- Drie redenen waarom celdeling belangrijk is
- Is CLITOCYBE dealbata een symbiont saprofyt of parasiet?
- Wetenschappers vinden ontbrekende schakel om te begrijpen hoe planten vitamine C aanmaken
- Wat is de wetenschappelijke naam van bamboe?
- Wat zijn twee cellen planten en er geen dierencellen?
- Hoe zijn cellen als fabrieken?
- Xist- en lapjeskatten:hoe extra genen op X-chromosomen worden uitgeschakeld
- Gene ontdekking kan cassaveziekte bestrijden, voedselzekerheid vergroten
- Het dieet van zijderupsen veranderen om sterkere zijde te spinnen

- Uitvinding van piepkleine organische films kan nieuwe elektronica mogelijk maken

- Een nieuwe methode voor de productie van geprotoneerde waterstof

- Onderzoekers verkleinen de technologie voor het nemen van vingerafdrukken van medicijnen en andere chemicaliën drastisch
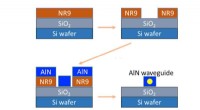
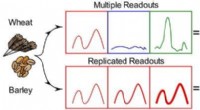
- Een stap in de richting van een gevoelige en snelle glutendetectie
 Kunnen ijsberen en narwallen zich vastklampen terwijl het ijs krimpt?
Kunnen ijsberen en narwallen zich vastklampen terwijl het ijs krimpt?  Kleine magnetische structuren versterken de medische wetenschap
Kleine magnetische structuren versterken de medische wetenschap Een verandering van de zee voor plasticvervuiling:nieuw materiaal breekt biologisch af in oceaanwater
Een verandering van de zee voor plasticvervuiling:nieuw materiaal breekt biologisch af in oceaanwater 13 Beschrijf het proces dat wordt gebruikt voor het oogsten van volwassen stamcellen?
13 Beschrijf het proces dat wordt gebruikt voor het oogsten van volwassen stamcellen?  Kan Jupiter vanaf de aarde worden gezien?
Kan Jupiter vanaf de aarde worden gezien?  Hoe verschillen de stoffen die zich vormen in een chemische reactie van React?
Hoe verschillen de stoffen die zich vormen in een chemische reactie van React?  Berekening van geïnduceerde ankervoltage
Berekening van geïnduceerde ankervoltage  Welk chromosoom vertelt ons het geslacht van een mens?
Welk chromosoom vertelt ons het geslacht van een mens?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

