
Wetenschap
Wat is de gedeeltelijke druk van koolstofdioxide in een container met 5 mol 3 stikstof en 1 mol waterstof heeft een totaal van 1,05 atm?
1. Gedeeltelijke druk begrijpen
Gedeeltelijke druk is de druk die wordt uitgeoefend door een enkel gas in een mengsel van gassen. Dalton's wet van gedeeltelijke druk stelt dat de totale druk van een gasmengsel de som is van de gedeeltelijke druk van elk individueel gas.
2. Bereken molfracties
* stikstof (n2): 3 mol / (3 mol + 1 mol) =0,75 (molfractie)
* waterstof (H2): 1 mol / (3 mol + 1 mol) =0,25 (molfractie)
3. Pas de wet van Dalton toe
Omdat we niet de mol CO2 krijgen, kunnen we de partiële druk niet direct berekenen. We kennen echter de totale druk (1,05 atm) en de molfracties van de andere gassen.
4. Ga uit van ideaal gasgedrag
We gaan ervan uit dat de gassen zich idealiter gedragen. Dit betekent dat de gedeeltelijke druk van elk gas evenredig is met de molfractie.
5. Oplossen voor de gedeeltelijke druk van CO2
* Laat P (CO2) de gedeeltelijke druk van kooldioxide zijn.
* Totale druk (ptotal) =p (n2) + p (h2) + p (CO2)
* P (CO2) =Ptotal - P (N2) - P (H2)
* P (CO2) =Ptotal - (molfractie van N2 * ptotal) - (molfractie van H2 * ptotal)
* P (CO2) =1,05 atm - (0,75 * 1,05 atm) - (0,25 * 1,05 atm)
* P (CO2) =0 ATM
Conclusie
De gedeeltelijke druk van koolstofdioxide in deze container is 0 atm . Dit betekent dat er waarschijnlijk geen koolstofdioxide aanwezig is in de container.
 Wat is een manier waarop de atomaire structuur van isotopen boor hetzelfde en verschillend is?
Wat is een manier waarop de atomaire structuur van isotopen boor hetzelfde en verschillend is?  Welke eerste ionisatie -energie is het meest waarschijnlijk voor een zeer reactief metaal?
Welke eerste ionisatie -energie is het meest waarschijnlijk voor een zeer reactief metaal?  Wat is een elektronische polarisatie van waterstofatoom?
Wat is een elektronische polarisatie van waterstofatoom?  Benzeen is een niet-polair molecuul en betekent dat het geen positieve of negatieve kant heeft welke verklaring het beste beschrijft hoe benzeen in water oplost?
Benzeen is een niet-polair molecuul en betekent dat het geen positieve of negatieve kant heeft welke verklaring het beste beschrijft hoe benzeen in water oplost?  Vooruit of achteruit? Nieuwe routes voor protonen in water-methanol
Vooruit of achteruit? Nieuwe routes voor protonen in water-methanol
Hoofdlijnen
- Wat is de massa stamcellen geproduceerd in de eerste paar dagen na ferlisatie?
- Hoe noemen biologen de populaties van vele soorten die een bepaalde plaats innemen?
- Welke is het dikste orgel in je lichaam?
- Zijn genderverschillen vooraf bepaald?
- Welk molecuul wordt geproduceerd in de mitochondria en heeft energie zijn bindingen opgeslagen?
- Welk deel van plantencel dat sterkte en stijfheid biedt?
- Bestaan allelen uit veel genen?
- Hoe kunt u vrij aminozuur isoleren van eiwitten?
- Nieuwe bevindingen laten zien hoe het influenzavirus menselijke cellen kaapt
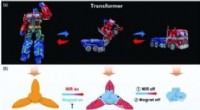
- Magnetisch gestuurd, op hydrogel gebaseerde slimme transformatoren
- Membraanloze protocellen kunnen aanwijzingen geven voor de vorming van het vroege leven

- Een nieuwe methode om waterstof efficiënter uit water te halen om duurzame energie op te vangen
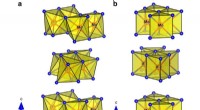
- Nieuw leven inblazen in bestaande technologie:FT-IR-spectrometer toont moleculaire oriëntatie

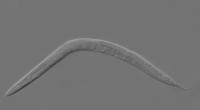
- Ontdekking van levensverlengingspad in wormen toont nieuwe manier om veroudering te bestuderen
 Wat is de meest voorkomende vaste vloeistof of gas voor niet -metalen elementen?
Wat is de meest voorkomende vaste vloeistof of gas voor niet -metalen elementen?  Wat is de definitie van Power Resource?
Wat is de definitie van Power Resource?  Ultracompacte metalens-microscopie doorbreekt FOV-beperkingen
Ultracompacte metalens-microscopie doorbreekt FOV-beperkingen Waarom moeten wetenschappers ervoor zorgen dat chemische vergelijkingen in evenwicht zijn?
Waarom moeten wetenschappers ervoor zorgen dat chemische vergelijkingen in evenwicht zijn?  Waarom is zuurstof elektronegatiefer dan zwavel?
Waarom is zuurstof elektronegatiefer dan zwavel?  Wat zijn eigenschappen van metaalverbindingen?
Wat zijn eigenschappen van metaalverbindingen?  Hoe de vorming van dag en nacht het rechtlijnige propagatielicht suggereren?
Hoe de vorming van dag en nacht het rechtlijnige propagatielicht suggereren?  Is dit waar of onwaar in een chemische verandering, andere vormen van energie kunnen niet worden gewijzigd in chemische energie?
Is dit waar of onwaar in een chemische verandering, andere vormen van energie kunnen niet worden gewijzigd in chemische energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

