
Wetenschap
Wat is de samenstelling van 0,1 natriumhydroxide?
1. 0,1 Molaire (M) Natriumhydroxide -oplossing:
* Dit verwijst naar een oplossing waarbij 0,1 mol natriumhydroxide (NaOH) wordt opgelost in 1 liter water.
* Dit is de meest voorkomende interpretatie.
2. 0,1 Normale (N) Natriumhydroxide -oplossing:
* Dit verwijst naar een oplossing waarbij 0,1 equivalenten natriumhydroxide in 1 liter water worden opgelost.
* Omdat NaOH één hydroxide -ion per molecuul heeft, is 0,1 N NaOH gelijk aan 0,1 M NaOH.
3. 0,1% (w/v) Natriumhydroxide -oplossing:
* Dit verwijst naar een oplossing waarbij 0,1 gram natriumhydroxide wordt opgelost in 100 ml water.
* Dit is een veel lagere concentratie dan de vorige twee voorbeelden.
Laten we ons concentreren op de meest voorkomende interpretatie (0,1 M NaOH -oplossing):
* Natriumhydroxide (NaOH): De opgeloste stof, een witte vaste stof.
* Water (H2O): Het oplosmiddel.
Hier is hoe u een 0,1 M NaOH -oplossing kunt voorbereiden:
1. Bereken de benodigde massa van NaOH:
* Molecuulgewicht van NaOH =40 g/mol
* 0,1 mol NaOH =0,1 mol * 40 g/mol =4 g
2. Los de NaOH in water op:
* Voeg zorgvuldig 4 g NaOH toe aan een volumetrische kolf met ongeveer 800 ml gedestilleerd water.
* Roer tot de NaOH volledig is opgelost.
* Voeg meer gedestilleerd water toe om het totale volume tot 1 liter te brengen.
BELANGRIJKE VEILIGHEID OPMERKING:
* Natriumhydroxide is een sterke basis en corrosief. Draag passende veiligheidsuitrusting (handschoenen, bril, laboratoriumjas) bij het werken ermee.
* Voeg NAOH altijd toe aan water, nooit andersom. Dit voorkomt een potentieel gevaarlijke exotherme reactie.
Laat het me weten als je nog andere vragen hebt!
Hoofdlijnen
- Wat onderscheidt mensen van chimpansees en andere apen?
- Welk deel is een vloeistof gevonden in dierencellen?
- Wat hebben fotosynthese en chemosynthese dat verschillend is?
- Wat betekent Crocodylidae?
- Wat doet fosfoglycerate kinase?
- Het DNA van micro -organismen is opgesteld subeenheden genaamd?
- Wat zijn de meest efficiënte biomoleculen voor het opslaan van energie. Zou het vetten nucleïnezuren zijn koolhydraten of eiwitten?
- Onderzoek werpt licht op hoe zeedieren stress overleven
- Welke planten moeten gezond groeien?
- Nieuwe microfluïdische chip verhoogt de gevoeligheid van immunoassays met 1000x

- Diamant uitrekken voor micro-elektronica van de volgende generatie

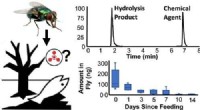
- Blaasvliegen kunnen worden gebruikt om het gebruik van chemische wapens en andere verontreinigende stoffen te detecteren
- Radicale ontziltingsaanpak kan de waterindustrie verstoren

- Eiwitomgeving maakt katalysator efficiënt voor waterstofproductie

 Vergelijk de hoeksnelheid van de aarde rond zijn eigen as met die uurhand een klok?
Vergelijk de hoeksnelheid van de aarde rond zijn eigen as met die uurhand een klok?  Wat is de energiebron die wordt gebruikt door de calciumpomp die zijn normale werking dreigt?
Wat is de energiebron die wordt gebruikt door de calciumpomp die zijn normale werking dreigt?  Wat is de zwaartekracht verzet?
Wat is de zwaartekracht verzet?  Hoe heet de verbinding met de formule al2so43?
Hoe heet de verbinding met de formule al2so43?  Hoe motiveer je studenten tijdens examentijd, volgens psychologen
Hoe motiveer je studenten tijdens examentijd, volgens psychologen Hoe kwamen de Britten op land of zee?
Hoe kwamen de Britten op land of zee?  De VS is een natie van voorsteden geworden
De VS is een natie van voorsteden geworden Kunstmatige intelligentie kan u helpen uw persoonlijke gegevens te beschermen
Kunstmatige intelligentie kan u helpen uw persoonlijke gegevens te beschermen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


