
Wetenschap
Hoeveel gram lood II -oxide zal worden geproduceerd door de ontleding 2,50 g carbonaat?
1. Schrijf de gebalanceerde chemische vergelijking:
PBCO₃ (S) → PBO (S) + Co₂ (G)
2. Bereken de molaire massa's:
* PBCO₃:207.2 g/mol (PB) + 12.01 g/mol (C) + 3 * 16,00 g/mol (O) =267,21 g/mol
* PBO:207.2 g/mol (PB) + 16,00 g/mol (O) =223,2 g/mol
3. Gebruik stoichiometrie om de massa PBO te vinden:
* Converteer grams van PBCO₃ naar mol:
2,50 g PBCO₃ * (1 mol PBCO₃ / 267.21 g PBCO₃) =0.00936 Mol PBCO₃
* Gebruik de molverhouding van de gebalanceerde vergelijking:
1 mol PBCO₃:1 mol PBO
Daarom zal 0,00936 mol PBCO₃ 0,00936 mol PBO produceren.
* Converteer mol PBO naar gram:
0.00936 MOL PBO * (223,2 g PBO / 1 mol PBO) = 2,09 g PBO
Antwoord: 2.09 gram lood (II) oxide zal worden geproduceerd door de ontleding van 2,50 gram lood (II) carbonaat.
 Een hoeveelheid heleum wordt verzameld boven water van 70 graden Celsius en het mengsel heeft een druk van 89,9 kPa. Welke partiële damp?
Een hoeveelheid heleum wordt verzameld boven water van 70 graden Celsius en het mengsel heeft een druk van 89,9 kPa. Welke partiële damp?  Kan de reactie FECL2 Plus Cu gelijk zijn aan Fe Cucl2 optreden?
Kan de reactie FECL2 Plus Cu gelijk zijn aan Fe Cucl2 optreden?  Onderzoekers ontwikkelen een op amfibieën geïnspireerde camouflagehuid
Onderzoekers ontwikkelen een op amfibieën geïnspireerde camouflagehuid  Biologische voedingsmiddelen verifiëren
Biologische voedingsmiddelen verifiëren Hoeveel moleculen zijn er in 0,65 mol zwaveldioxide?
Hoeveel moleculen zijn er in 0,65 mol zwaveldioxide?
 Hoe noem je de persoon die bloemen en planten bestudeert?
Hoe noem je de persoon die bloemen en planten bestudeert?  Noem de vier takken als Earth Science?
Noem de vier takken als Earth Science?  Klimaatverandering maakt meren minder blauw
Klimaatverandering maakt meren minder blauw Dodelijke cycloon in Bangladesh, een van de langst geziene
Dodelijke cycloon in Bangladesh, een van de langst geziene  Opkomende landbouw en landschapsverstoringen bedreigen de doelstellingen van het klimaatakkoord van Parijs
Opkomende landbouw en landschapsverstoringen bedreigen de doelstellingen van het klimaatakkoord van Parijs
Hoofdlijnen
- Waarom worden experimenten waarbij transplanterende soorten worden uitgevoerd die vandaag zelden worden uitgevoerd?
- Wat zijn speciale cel?
- Is voet biotisch of abioitisch?
- Wat zijn drie soorten wetenschappelijke modellen?
- Zal geautomatiseerde landbouw helpen tegemoet te komen aan de voedselvraag in de wereld?
- Wat betekent scheiden in de menselijke biologie?
- Waarom werkt natuurlijke selectie alleen aan fenotypes?
- Wat is een eukaryote en hoe geclassificeerd?
- Welk element wordt gevonden in zowel nucleïnezuren als eiwitten?
- Rekbaar, zelfherstellende en halfgeleidende polymeerfilms voor elektronische huid (e-skin)
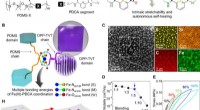
- Alginezuur verbetert kunstmatige botten

- Een nieuwe strategie voor een groener gebruik van calciumcarbide
- Onderzoekers bedenken nieuw proces om suikers uit hout te extraheren

- Duurzaam bouwen met milieuvriendelijk beton

 Welke zones van de oceanen diepst?
Welke zones van de oceanen diepst?  Pneumatiek en Hydrauliek Projecten
Pneumatiek en Hydrauliek Projecten Autonome viervoeter ontworpen om samen te werken met soldaten
Autonome viervoeter ontworpen om samen te werken met soldaten Wat zou een chlooratoom de neiging hebben om te binden aan een andere vorm een ionische verbinding en waarom?
Wat zou een chlooratoom de neiging hebben om te binden aan een andere vorm een ionische verbinding en waarom?  Wat is een goede dirigent van eletriciteit?
Wat is een goede dirigent van eletriciteit?  Wat is de wetenschappelijke definitie van ruimte?
Wat is de wetenschappelijke definitie van ruimte?  Absorberen atomen dezelfde energie?
Absorberen atomen dezelfde energie?  Wat is de Vant Hoff-factor voor NaCl als het volledig dissocieert in water?
Wat is de Vant Hoff-factor voor NaCl als het volledig dissocieert in water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

