
Wetenschap
Wanneer elementen worden gerangschikt in volgorde van toenemend atoomnummer, is er een periodieke herhaling hun chemische en fysische eigenschappenverklaring de?
Hier is een meer complete uitleg:
De periodieke wet stelt dat de chemische en fysische eigenschappen van elementen periodieke functies van hun atoomaantallen zijn.
Dit betekent dat wanneer elementen worden gerangschikt in volgorde van het toenemende atoomnummer, hun eigenschappen herhalen in een regelmatig patroon. Dit patroon wordt weergegeven in de periodieke tabel, waarbij elementen met vergelijkbare eigenschappen samen worden gegroepeerd in kolommen (groepen) en rijen (perioden).
Hier zijn enkele belangrijke aspecten van de periodieke wet:
* Atomisch nummer: Het aantal protonen in de kern van een atoom.
* chemische eigenschappen: Hoe een element interageert met andere elementen om verbindingen te vormen.
* Fysieke eigenschappen: Kenmerken zoals smeltpunt, kookpunt, dichtheid en geleidbaarheid.
* Periodieke herhaling: Soortgelijke eigenschappen komen op een regelmatige manier terug terwijl u over en neer in het periodiek systeem gaat.
Voorbeelden:
* Alkali -metalen (groep 1): Zeer reactieve metalen hebben allemaal één valentie -elektron.
* halogenen (groep 17): Reactieve niet -metalen hebben allemaal zeven valentie -elektronen.
* nobele gassen (groep 18): Niet -reactieve gassen hebben allemaal een volledige buitenste schaal van elektronen.
Het periodieke wet is een fundamenteel principe in de chemie, waardoor we het gedrag van elementen kunnen begrijpen en voorspellen op basis van hun positie in het periodieke tabel.
 Nicotine Hoe werkt
Nicotine Hoe werkt  Hoeveel mol zilvernitraat zijn er nodig om volledig te reageren met 0,327 mol natriumcloride?
Hoeveel mol zilvernitraat zijn er nodig om volledig te reageren met 0,327 mol natriumcloride?  Waterstofbinding vindt plaats in moleculen waar waterstof is gebonden aan welke elementen fluor koolstofzuurstof stikstofboor?
Waterstofbinding vindt plaats in moleculen waar waterstof is gebonden aan welke elementen fluor koolstofzuurstof stikstofboor?  Wanneer zijn de moleculen dicht bij elkaar in een object?
Wanneer zijn de moleculen dicht bij elkaar in een object?  Wat hebben fluor en chloor gemeen?
Wat hebben fluor en chloor gemeen?
 Antarctica is nog steeds vrij van COVID-19. Kan dat zo blijven?
Antarctica is nog steeds vrij van COVID-19. Kan dat zo blijven? Een strategische onderzoeksagenda om land en bodem in Europa beter te benutten
Een strategische onderzoeksagenda om land en bodem in Europa beter te benutten Sedimenten onthullen moessonneerslagmechanisme in centraal-oostelijk China
Sedimenten onthullen moessonneerslagmechanisme in centraal-oostelijk China Deze kleine oceanische wezens zijn essentieel om de klimaatverandering aan te pakken
Deze kleine oceanische wezens zijn essentieel om de klimaatverandering aan te pakken Nieuwe kaart laat zien hoe de klimaatverandering uw gemeenschap en haar kwetsbaarheid voor weersomstandigheden beïnvloedt
Nieuwe kaart laat zien hoe de klimaatverandering uw gemeenschap en haar kwetsbaarheid voor weersomstandigheden beïnvloedt
Hoofdlijnen
- Nieuwe ontdekking om de ontwikkeling van zouttolerante wijnstokken te versnellen
- Massa-extincties verwijderen soorten, maar geen ecologische variëteit
- Wat betekent van componenten in onderzoek?
- Hoe de verschillende soorten alveolaire cellen te identificeren
- Hoe ontwikkelen pathogenen nieuwe virulentie-activiteiten, en waarom doet dat ertoe?
- Onderzoekers concentreren zich op de manier waarop bacteriën voedselvergiftiging veroorzaken
- Honingbijen steken minder snel in grotere groepen
- Biologen ontdekken hoe virussen de machinerie van cellen kapen
- Dennenpollen worden voornamelijk verspreid door?
- Verschillen in vetweefsel lichtreflecterende eigenschappen zorgen voor gemakkelijke detectie

- Wetenschappers brengen polymeren in focus op atomaire schaal

- Gel bestrijdt medicijnresistente bacteriën en stimuleert de natuurlijke afweer van het lichaam

- Origami inspireert nieuwe technologie voor weefselregeneratie

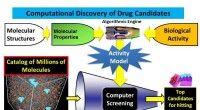
- Algoritme leidt tot een dramatische verbetering van methoden voor het ontdekken van geneesmiddelen
 De elementen van het leven in kaart gebracht over de Melkweg door SDSS/APOGEE
De elementen van het leven in kaart gebracht over de Melkweg door SDSS/APOGEE Wat zijn de drie redenen waarom celdeling moet plaatsvinden?
Wat zijn de drie redenen waarom celdeling moet plaatsvinden?  Welke twee dingen doen potentieel en kinetische energie nodig om meer energie te krijgen?
Welke twee dingen doen potentieel en kinetische energie nodig om meer energie te krijgen?  Wat is de verste planeet in uw zonnestelsel?
Wat is de verste planeet in uw zonnestelsel?  Wat zijn de krachten op een vallend object in balans en vallen met constante snelheid?
Wat zijn de krachten op een vallend object in balans en vallen met constante snelheid?  Wat is de potentiële energie van een kilogram -platte plat die op 1 meter plantstandaard?
Wat is de potentiële energie van een kilogram -platte plat die op 1 meter plantstandaard?  Hoe een broodje Manuka-honing de sleutel zou kunnen zijn tot het bestrijden van infecties
Hoe een broodje Manuka-honing de sleutel zou kunnen zijn tot het bestrijden van infecties  Hoe zien de manen van Mars eruit?
Hoe zien de manen van Mars eruit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

