
Wetenschap
Wat is de theoretische opbrengst van bromobenzeen in deze reactie wanneer benzeen van 26,0 g reageert met 56.3 broom?
1. Evenwichtige chemische vergelijking:
De reactie van benzeen met broom om bromobenzeen te produceren is:
C₆h₆ + br₂ → c₆h₅br + hbr
2. Molaire massa's:
* Benzeen (c₆h₆):78.11 g/mol
* Bromine (Br₂):159,80 g/mol
* Bromobenzeen (c₆h₅br):157.01 g/mol
3. Bepaal de beperkende reactant:
* Bereken mol benzeen: (26,0 g) / (78,11 g / mol) =0,333 mol
* Bereken mol bromine: (56,3 g) / (159,80 g / mol) =0,352 mol
De evenwichtige vergelijking toont een 1:1 molverhouding tussen benzeen en broom. Omdat we iets meer mol broom hebben, is benzeen de beperkende reactant.
4. Bereken theoretische opbrengst:
* Gebruik de molverhouding van de gebalanceerde vergelijking: 1 mol benzeen produceert 1 mol bromobenzeen.
* Bereken mol bromobenzeen geproduceerd: 0,333 mol benzeen * (1 mol bromobenzeen / 1 mol benzeen) =0,333 mol bromobenzeen
* Moles van bromobenzeen omzetten in gram: (0,333 mol) * (157,01 g/mol) = 52,3 g bromobenzeen
Daarom is de theoretische opbrengst van bromobenzeen 52,3 gram.
Hoofdlijnen
- De mitochondrion is de plaats in cel waar wat er gebeurt?
- Hoe kunt u voedselproductie en gezondheid van het levensonderhoud bevorderen op basis van uw begrip van de functie van de celstructuur?
- Wat zijn herverschillende erytrocyten?
- Containergebaseerde methode lost problemen op bij het recirculeren van viskweek
- Kunnen golden retrievers langer leven? Onderzoekers vinden genen die verband houden met een lang leven in het ras
- Wat wordt bedoeld met wetenschappelijke methoden?
- Onderzoek toont aan waardoor de celwanden van planten worden samengedrukt en uitgerekt
- Wat is de functie van een vacuole in plantencellen?
- Wat is een gemeenschap van organismen samen met de niet -levende onderdelenomgeving?
- Team ontwikkelt peptide dat resistente bacteriën weer gevoelig maakt voor antibiotica

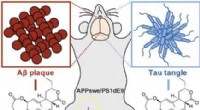
- Wortelbacterie om Alzheimer te bestrijden:Rhizolutin dissocieert bèta- en tau-aggregaten
- Efficiënte synthese van ginkgo-verbinding kan leiden tot nieuwe medicijnen, groene insecticiden

- Enzymen en bacteriën bewegen richting, maar bacteriën naar voedsel, enzymen weg
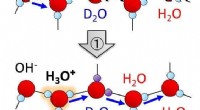
- Unieke structurele fluctuaties aan het ijsoppervlak bevorderen auto-ionisatie van watermoleculen
 CT-scanstudie maakt het mogelijk om de schedel van de dinosaurussoort massospondylus in 3D te printen
CT-scanstudie maakt het mogelijk om de schedel van de dinosaurussoort massospondylus in 3D te printen Welke voorzorgsmaatregelen moeten tijdens een naakte zonsverduistering worden genomen om de veiligheid te waarborgen en de ogen te beschermen tegen mogelijke schade?
Welke voorzorgsmaatregelen moeten tijdens een naakte zonsverduistering worden genomen om de veiligheid te waarborgen en de ogen te beschermen tegen mogelijke schade?  Wat is een alkalimengsel?
Wat is een alkalimengsel?  Heet op de hielen van quasideeltjes
Heet op de hielen van quasideeltjes Welke is langer 30 cm of 300 mm?
Welke is langer 30 cm of 300 mm?  Bill Gates roept op tot meer wereldwijde evaluatiegegevens van het onderwijs
Bill Gates roept op tot meer wereldwijde evaluatiegegevens van het onderwijs Wat maakt 2 verbindingen met dezelfde hydrofobie verschillende partitiecoëfficiënten?
Wat maakt 2 verbindingen met dezelfde hydrofobie verschillende partitiecoëfficiënten?  Maak kennis met het nieuwe prototype in de technologie voor de sanering van elektromagnetische olielozingen
Maak kennis met het nieuwe prototype in de technologie voor de sanering van elektromagnetische olielozingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


