
Wetenschap
Zijn alle fosfaatzouten oplosbaar in water?
Hier is een uitsplitsing:
* In het algemeen zijn fosfaten van groep 1 (alkalimetaal) en ammoniumfosfaten oplosbaar in water. Voorbeelden zijn:
* Natriumfosfaat (Na₃po₄)
* Kaliumfosfaat (k₃po₄)
* Ammoniumfosfaat ((NH₄) ₃po₄)
* fosfaten van groep 2 (alkalische aardmetalen) zijn over het algemeen onoplosbaar in water. Voorbeelden zijn:
* Calciumfosfaat (Ca₃ (PO₄) ₂)
* Magnesiumfosfaat (mg₃ (po₄) ₂)
* De oplosbaarheid van andere metaalfosfaten varieert. Sommige overgangsmetaalfosfaten zijn onoplosbaar, terwijl andere enigszins oplosbaar zijn.
Factoren die de oplosbaarheid beïnvloeden:
* kationgrootte en lading: Kleinere, sterk geladen kationen vormen de neiging om meer oplosbare zouten te vormen.
* aniongrootte en lading: Grotere, sterker geladen anionen hebben de neiging om minder oplosbare zouten te vormen.
* Temperatuur: De oplosbaarheid van de meeste zouten neemt toe met de temperatuur.
Belangrijke opmerking: Zelfs "onoplosbare" zouten kunnen in water in water oplossen. Dit wordt lichte oplosbaarheid genoemd .
Om de oplosbaarheid van een specifiek fosfaatzout te bepalen, kunt u een oplosbaarheidstabel of een chemie -leerboek raadplegen.
 Hoe verhoudt de dichtheid zich tot vloeibare lagen?
Hoe verhoudt de dichtheid zich tot vloeibare lagen?  Wat is de mercurische nitraatmethode voor het bepalen van chloride in water?
Wat is de mercurische nitraatmethode voor het bepalen van chloride in water?  Welk molecuul is butyn?
Welk molecuul is butyn?  Wat zijn de typische soorten representatieve deeltjes die worden gebruikt in scheikundige berekeningen?
Wat zijn de typische soorten representatieve deeltjes die worden gebruikt in scheikundige berekeningen?  Wat is de vergelijking voor reactie met gas in lucht?
Wat is de vergelijking voor reactie met gas in lucht?
 Soorten cocons
Soorten cocons Uit onze diepte:diepzeemijnbouw is niet het antwoord op de klimaatcrisis
Uit onze diepte:diepzeemijnbouw is niet het antwoord op de klimaatcrisis Nieuwe bevindingen over lachgasemissies van noordelijke bomen verrasten wetenschappers
Nieuwe bevindingen over lachgasemissies van noordelijke bomen verrasten wetenschappers Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS
Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS Gezondheidsgroepen roepen op tot non-proliferatieverdrag voor fossiele brandstoffen
Gezondheidsgroepen roepen op tot non-proliferatieverdrag voor fossiele brandstoffen
Hoofdlijnen
- Was de oersoep een stevige pre-eiwitstoofpot?
- Wat voor soort wetenschapper bestudeert gedrag en eigenschappen?
- IJzer-zwavelmineralen kunnen getuigen van de eerste microben op aarde die miljarden jaren geleden leefden
- Wat resulteert in de meest diverse nakomelingen?
- Nieuw gevonden tandring onthult hoe gemeenschappelijke voorouder-ruiende dieren eruit zagen
- Kan DNA -polymerase de sequentie proeflezen?
- Als een DNA-streng de sequentie heeft, zal aagctc-transcriptie resulteren in?
- Waarom jouw voorouders het verspringen zouden hebben gedaan
- Planten herprogrammeren hun cellen om indringers te bestrijden. Hier is hoe
- Belangrijke mijlpaal op weg naar overgangsmetaalkatalyse met aluminium
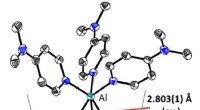
- Onderzoekers creëren slimme oppervlakken om bloedvattransplantaten beter te laten breien, veiliger

- Waterdruppels als geminiaturiseerde reageerbuisjes

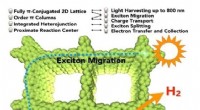
- Fotokatalytische waterstofproductie uit water
- Effectief materiaal ontwikkeld om postoperatieve hechting te voorkomen

 Waarom worden planten beschouwd als zelfstandig leven?
Waarom worden planten beschouwd als zelfstandig leven?  Waarom het Europese klimaat een stormachtige toekomst tegemoet gaat
Waarom het Europese klimaat een stormachtige toekomst tegemoet gaat  Nieuw ontdekte organische nanodraden laten door de mens gemaakte technologieën in hun stof achter
Nieuw ontdekte organische nanodraden laten door de mens gemaakte technologieën in hun stof achter Boven Krijt geulafzettingen van de Neo-Tethyan subductiezone
Boven Krijt geulafzettingen van de Neo-Tethyan subductiezone Hoe heeft de katoenplant zich aangepast om te overleven?
Hoe heeft de katoenplant zich aangepast om te overleven?  Fotonen routeren met een topologische fotonische structuur
Fotonen routeren met een topologische fotonische structuur Is het waar dat wrijvingen objecten versnellen?
Is het waar dat wrijvingen objecten versnellen?  Waarom wordt waterstof vandaag gebruikt?
Waarom wordt waterstof vandaag gebruikt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

