
Wetenschap
Wat voor soort zwavel -niet -metaaleigenschappen heeft het?
Algemene niet -metalen kenmerken:
* Slechte warmtegeleider en elektriciteit: Zwavel is een slechte geleider van zowel warmte als elektriciteit. Dit komt omdat zijn elektronen strak gebonden zijn binnen zijn atomen, waardoor het voor hen moeilijk is om vrij te bewegen.
* bros: Zwavel is bros, wat betekent dat het gemakkelijk breekt wanneer het wordt onderworpen aan stress. Dit is ook te wijten aan de sterke bindingen tussen zijn atomen.
* Doffe uiterlijk: Zwavel heeft een karakteristieke gele kleur en wordt vaak beschreven als een saai, poederachtig uiterlijk.
* Laag smelt- en kookpunten: Zwavel heeft een relatief laag smeltpunt (115,21 ° C) en kookpunt (444,6 ° C) vergeleken met metalen. Dit komt omdat de bindingen tussen zwavelatomen relatief zwak zijn.
Specifieke zwavelseigenschappen:
* Allotropie: Zwavel bestaat in meerdere allotropen, wat betekent dat het kan bestaan in verschillende structurele vormen met verschillende eigenschappen. Rhombische zwavel en monokline zwavel zijn bijvoorbeeld twee gemeenschappelijke allotropen.
* Reactiviteit: Zwavel is reactief met vele andere elementen, met name metalen. Het vormt sulfiden met metalen, die vaak in de natuur als ertsen worden gevonden.
* geur: Zwavelverbindingen kunnen sterke, vaak onaangename geuren hebben. Waterstofsulfide (H2S) staat bijvoorbeeld bekend om zijn rotte eiergeur.
* Oxidatie stelt: Zwavel kan verschillende oxidatietoestanden vertonen, variërend van -2 tot +6. Hierdoor kan het deelnemen aan een breed scala aan chemische reacties.
* Gebruik: Zwavel wordt gebruikt in verschillende industriële toepassingen, waaronder de productie van zwavelzuur (H2SO4), een belangrijke industriële chemische stof die wordt gebruikt bij de productie -meststoffen, wasmiddelen en batterijen. Zwavel wordt ook gebruikt in vulkaniserend rubber, waardoor het duurzamer en veerkrachtiger wordt.
Key Takeaway: Zwavel vertoont een reeks niet -metalen eigenschappen, waaronder slechte geleidbaarheid, brosheid, een saai uiterlijk en lage smelt- en kookpunten. De unieke allotropen en reactiviteit maken het een waardevol element voor verschillende industriële toepassingen.
Hoofdlijnen
- Welke organismen zijn verantwoordelijk voor het stromend houden van de stikstofcyclus?
- Het mysterie van de oorsprong van veren:hoe donzige pterosauriërs het debat opnieuw hebben aangewakkerd
- Onderzoek naar schapengenen kan helpen om gezondere dieren te fokken
- Welke mechanismen leiden tot genetische variatie?
- Waar is de dunne darm aan verbonden?
- 'Wat als er een stoere Barbie bestond?' Barbie's genderpolitiek onderzocht
- Wat is het maening van de ademhaling?
- Een groep van een cel die een specifieke functie uitvoert?
- Kleine moleculen behouden stamcellen:Onderzoekers laten zien wat constante plantengroei mogelijk maakt
- Wetenschappers maken eerste biomoleculaire simulatie van miljarden atomen

- Softwarebibliotheek voor snellere verwerking van chemische reacties

- Wetenschappers ontwikkelen een manier om afvalplastic te gebruiken om autobrandstof te maken

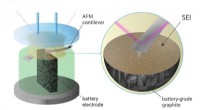
- Wetenschappers krijgen een voorproefje van een belangrijk proces in de levensduur van de batterij
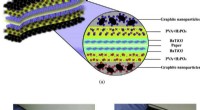
- De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
 Kunnen plantengelijkenissen de vrede bevorderen?
Kunnen plantengelijkenissen de vrede bevorderen?  Kun je rotatiebeweging van een fietswiel omzetten in elektrische energie?
Kun je rotatiebeweging van een fietswiel omzetten in elektrische energie?  Zijn tuimelende onkruid biotisch of abiotisch?
Zijn tuimelende onkruid biotisch of abiotisch?  Wat is de beste manier om een objecten kinetische energie te vergroten?
Wat is de beste manier om een objecten kinetische energie te vergroten?  Vrienden met voordelen:kan Facebook je liefdesleven aanpakken?
Vrienden met voordelen:kan Facebook je liefdesleven aanpakken? Welke golf vereist geen medium, maar kan door lege ruimte reizen?
Welke golf vereist geen medium, maar kan door lege ruimte reizen?  Microsoft Defender komt naar apparaten met Android, iOS
Microsoft Defender komt naar apparaten met Android, iOS Waarom zijn er relatief weinig naschokken bij bepaalde aardbevingen in Cascadia?
Waarom zijn er relatief weinig naschokken bij bepaalde aardbevingen in Cascadia?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


