
Wetenschap
Als 100 g CUS en 56 O2 beschikbaar zijn, wat is de beperkende reactant?
1. Schrijf de gebalanceerde chemische vergelijking:
2 CUS + 3 O₂ → 2 Cuo + 2 So₂
2. Converteer gram reactanten in mol:
* CUS:
* Molaire massa van Cus =63,5 g/mol (cu) + 32,1 g/mol (s) =95,6 g/mol
* Mol Cus =100 g / 95,6 g / mol =1,046 mol
* o₂:
* Molaire massa van o₂ =2 * 16 g/mol =32 g/mol
* Mol O₂ =56 g / 32 g / mol =1,75 mol
3. Bepaal de molverhouding van reactanten:
De gebalanceerde vergelijking laat zien dat 2 mol CU's reageren met 3 mol O₂.
4. Bereken de mol O₂ die nodig is om volledig te reageren met de beschikbare CUS:
* Mol o₂ nodig =(1,046 mol cus) * (3 mol o₂ / 2 mol cus) =1,569 mol o₂
5. Vergelijk de berekende o₂ die nodig is met de beschikbare o₂:
* We hebben 1.569 mol O₂ nodig, maar hebben slechts 1,75 mol. Dit betekent dat we overtollig o₂ hebben .
Conclusie:
Omdat we minder o₂ hebben dan nodig om met alle CU's te reageren, is CUS de beperkende reactant.
 5 ideeën voor experimenten om energie te besparen
5 ideeën voor experimenten om energie te besparen  Klimaatverandering bedreigt enkele van 's werelds beste wijnen
Klimaatverandering bedreigt enkele van 's werelds beste wijnen Wat is één ding dat alle levende dingen gemeen hebben?
Wat is één ding dat alle levende dingen gemeen hebben?  Slechts 25 megasteden produceren 52% van 's werelds stedelijke uitstoot van broeikasgassen
Slechts 25 megasteden produceren 52% van 's werelds stedelijke uitstoot van broeikasgassen Uit een Canadees onderzoek blijkt dat eten zoals wij dat doen schadelijk is voor ons en de planeet
Uit een Canadees onderzoek blijkt dat eten zoals wij dat doen schadelijk is voor ons en de planeet
Hoofdlijnen
- Wat produceert aerobe cellulaire ademhaling?
- Hier is hoe planten- en dierencellen verschillen
- Wat is een domein in de wetenschap?
- Muggen gebruiken darmbacteriën om de malaria die ze overbrengen te bestrijden. Wetenschappers onderzoeken hoe dit komt
- Hoe het luisteren naar het juiste gezoem ervoor zorgt dat muggen niet met de verkeerde soort paren
- Een geneesmiddel tegen de ineenstorting van de honingbijkolonie?
- Welke structuur regelt de reproductie van de cel?
- Is eclips gelijk aan nacht in het plantenleven? Onderzoekers testen plantritmes tijdens zonsverduistering
- Wat is de enige taxonomische categorie die bestaat als een discrete eenheid in de natuur?
- Onderzoekers ontdekken nieuw proces voor ladingsoverdracht en scheiding
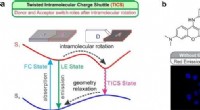
- Zuur kan een belangrijk ingrediënt zijn voor een betere kleefkracht, elektronische componenten

- De vorm van zachte materie veranderen met behulp van logische circuits gemaakt van DNA
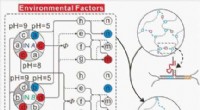
- Nieuw materiaal met magnetisch vormgeheugen

- Aluminium en lasers gebruiken om buigbaar glas te maken

 Wat bijna alle talen gemeen hebben, of je nu spreekt of gebaren
Wat bijna alle talen gemeen hebben, of je nu spreekt of gebaren  Welke vulkanen worden gevolgd door de AVO?
Welke vulkanen worden gevolgd door de AVO?  Nieuw instrument ontrafelt de levensduur van het landschap
Nieuw instrument ontrafelt de levensduur van het landschap Nieuwe methode brengt chemicaliën in de huid in kaart
Nieuwe methode brengt chemicaliën in de huid in kaart Welke wiskundige concepten zijn nodig om klassen op universitair niveau te begrijpen?
Welke wiskundige concepten zijn nodig om klassen op universitair niveau te begrijpen?  Probe maakt tumoronderzoek mogelijk met behulp van complementaire beeldvormingstechnieken
Probe maakt tumoronderzoek mogelijk met behulp van complementaire beeldvormingstechnieken Het mysterie van zware elementen in galactische kosmische straling
Het mysterie van zware elementen in galactische kosmische straling Wat zijn actieve galactische kernen?
Wat zijn actieve galactische kernen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

