
Wetenschap
Hybride orbitalen die worden gebruikt door chloor in CLF5?
1. Lewis -structuur
* Chloor is het centrale atoom, omgeven door vijf fluoratomen.
* Chloor heeft 7 valentie -elektronen en elke fluor heeft 7.
* Om de octetregel te bevredigen, vormt chloor vijf enkele bindingen met fluor, waardoor één eenzaam paar op chloor achterblijft.
2. Elektronedomeingeometrie
* Elektronendomeinen: Chloor heeft 6 elektronendomeinen:5 bindingsdomeinen en 1 eenzaam paar.
* geometrie van elektrondelen: Gebaseerd op de 6 elektronendomeinen, is de geometrie van de elektronedomein octaëdral.
3. Moleculaire geometrie
* eenzaam paar -effect: Het enige paar op chloor zal de vorm enigszins vervormen, wat resulteert in een vierkante piramidale moleculaire geometrie.
4. Hybridisatie
* Aantal hybride orbitalen: Omdat er 6 elektronendomeinen zijn, heeft chloor 6 hybride orbitalen nodig.
* Hybridisatietype: De hybridisatie die 6 orbitalen produceert, is sp³d² (één s, drie p en twee d orbitalen).
Conclusie
Chloor in CLF5 maakt gebruik van SP³d² Hybride orbitalen Om de vijf bindingen met fluor te vormen en het enige paar te huisvesten.
 Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken
Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken  Waar worden de metalliods gevonden op het periodieke tabel?
Waar worden de metalliods gevonden op het periodieke tabel?  Wat is de chemische formule van cadaverine?
Wat is de chemische formule van cadaverine?  Machine learning-technieken verbeteren de analyse van röntgenmateriaal
Machine learning-technieken verbeteren de analyse van röntgenmateriaal  Wat is een vervanging voor zilvernitraat?
Wat is een vervanging voor zilvernitraat?
 Baanbrekende ontdekking bewijst eindelijk dat regen echt bergen kan verzetten
Baanbrekende ontdekking bewijst eindelijk dat regen echt bergen kan verzetten Onderzoek toont aan dat veel voorkomende waterverontreinigende stoffen hartbeschadiging bij vissen veroorzaken
Onderzoek toont aan dat veel voorkomende waterverontreinigende stoffen hartbeschadiging bij vissen veroorzaken  Het meest voorkomende element in het menselijk lichaam is?
Het meest voorkomende element in het menselijk lichaam is?  Menselijke verstoringen en omgevingsveranderingsfactoren beïnvloeden biologische stikstoffixatie in terrestrische ecosystemen
Menselijke verstoringen en omgevingsveranderingsfactoren beïnvloeden biologische stikstoffixatie in terrestrische ecosystemen In een ecosysteem gaat niets verloren?
In een ecosysteem gaat niets verloren?
Hoofdlijnen
- Stoned Ape Theory:magische paddestoelen en menselijke evolutie
- Wetenschappers duiken diep in hoe haaien de oceaan gebruiken
- Angiogenese versus vasculogenese
- Veel soorten algen hebben welke organisatie?
- Wetenschappers ontcijferen mechanismen die ten grondslag liggen aan de biologie van veroudering
- Wat moet er waar zijn dat een hypothese door wetenschapper algemeen wordt geaccepteerd?
- Onderzoekers onthullen PI3K-enzymen met dubbele versneller- en remmechanismen
- Wat zijn de 6 componenten van gezondheid en hun betekenis?
- Hoe de delen van de menselijke schedel te leren
- Wetenschappers halen waterstofgas uit olie en bitumen, potentiële vervuilingsvrije energie geven

- Bescherming van ribosoomgenen om veroudering te voorkomen
- Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering

- Elastomeren ontwikkelen sterkere hechtingsbanden
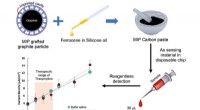
- Nieuwe, op grafiet gebaseerde snelle sensorchip voor realtime theofyllinebewaking
 Welke weerstandsapparatuur kan dubbel positief worden genoemd?
Welke weerstandsapparatuur kan dubbel positief worden genoemd?  Wat gebeurt er met de bodem als het regenwoud wordt gekapt?
Wat gebeurt er met de bodem als het regenwoud wordt gekapt?  Wat zijn de beste voedingsmiddelen om de energie te verhogen?
Wat zijn de beste voedingsmiddelen om de energie te verhogen?  Gaan theedrinkers meer betalen voor een klimaatvriendelijke beker?
Gaan theedrinkers meer betalen voor een klimaatvriendelijke beker? Nieuwe satellietmetingen laten zien hoe vervuild de lucht in Los Angeles werkelijk is
Nieuwe satellietmetingen laten zien hoe vervuild de lucht in Los Angeles werkelijk is  Vrouwelijke werkzoekenden die minder vrouwelijke taal gebruiken, hebben minder kans om aangenomen te worden, studie vondsten
Vrouwelijke werkzoekenden die minder vrouwelijke taal gebruiken, hebben minder kans om aangenomen te worden, studie vondsten Onderzoekers ontdekken hoe een nanokamer in de cel de eiwitvouwing stuurt
Onderzoekers ontdekken hoe een nanokamer in de cel de eiwitvouwing stuurt  Welke kenmerken is het kookpunt van een vloeistof gerelateerd?
Welke kenmerken is het kookpunt van een vloeistof gerelateerd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

