
Wetenschap
Wat is de redox -vergelijking voor oxidatie van koperjodide?
1. Oxidatie door zuurstof:
* reactie: 4 cui + o₂ + 2 h₂o → 2 cu₂o + 4 hi hi
* Redox halfreacties:
* Oxidatie:4 cui → 4 cu⁺ + 4 i⁻ + 4 e⁻
* Reductie:O₂ + 4 E⁻ + 2 H₂o → 4 oh⁻
* Verklaring: Koper (i) jodide wordt geoxideerd tot koper (i) oxide (cu₂o) en jodiumionen (i⁻). Zuurstof wordt gereduceerd tot hydroxide -ionen (OH⁻). Deze reactie zal waarschijnlijk optreden in aanwezigheid van lucht of zuurstof.
2. Oxidatie door sterke oxiderende middelen:
* reactie: Cui + 2 hno₃ → cu (no₃) ₂ + i₂ + h₂o
* Redox halfreacties:
* Oxidatie:2 cui → 2 cu²⁺ + 2 i⁻ + 4 e⁻
* Reductie:2 Hno₃ + 4 E⁻ → 2 No₂ + 2 H₂o
* Verklaring: In dit geval werkt salpeterzuur (HNO₃) als een sterk oxidatiemiddel, oxideren van koper (I) jodide tot koper (II) nitraat (Cu (NO₃) ₂) en elementair jodium (I₂). Het salpeterzuur is gereduceerd tot stikstofdioxide (NO₂).
belangrijke opmerkingen:
* De specifieke reactie en producten zijn afhankelijk van het gebruikte oxidatiemiddel en de reactieomstandigheden.
* Koper (i) jodide is relatief stabiel in lucht en water, maar het kan worden geoxideerd door sterke oxiderende middelen.
* De hierboven genoemde reacties zijn vereenvoudigde representaties en weerspiegelen mogelijk niet volledig de complexiteit van de feitelijke processen.
Het is belangrijk om betrouwbare chemische bronnen te raadplegen voor gedetailleerde informatie over de oxidatie van koperjodide.
 Wat is de functie van vloeibaar wasmiddel bij DNA-isolatie?
Wat is de functie van vloeibaar wasmiddel bij DNA-isolatie?  Waarom gebruikt wetenschapper Robert Hazen drukbommen om mineralen op te blazen?
Waarom gebruikt wetenschapper Robert Hazen drukbommen om mineralen op te blazen?  Kan zuiveringszout slecht worden als het met water wordt gemengd?
Kan zuiveringszout slecht worden als het met water wordt gemengd?  Wanneer zink reageert met sulfuirczuur Welke waterstofmassa wordt geproduceerd uit 31,8 g zink?
Wanneer zink reageert met sulfuirczuur Welke waterstofmassa wordt geproduceerd uit 31,8 g zink?  Hoe zuurstof uit vloeibare lucht te scheiden
Hoe zuurstof uit vloeibare lucht te scheiden
 Als een manier om klimaatverandering tegen te gaan, niet alle bodems zijn gelijk gemaakt
Als een manier om klimaatverandering tegen te gaan, niet alle bodems zijn gelijk gemaakt De rook van natuurbranden treft de inheemse gemeenschappen in Californië onevenredig zwaar, zo blijkt uit nieuw onderzoek
De rook van natuurbranden treft de inheemse gemeenschappen in Californië onevenredig zwaar, zo blijkt uit nieuw onderzoek  Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste
Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste Wat is een kortere definitie van het broeikaseffect?
Wat is een kortere definitie van het broeikaseffect?  Hoe kan Indonesië het REDD+-project verbeteren om ontbossing te stoppen?
Hoe kan Indonesië het REDD+-project verbeteren om ontbossing te stoppen?
Hoofdlijnen
- Wat is de betekenis van het afleiden van het wetenschapsproces?
- Welke delen zijn zichtbaar in een kikkerbloedcel?
- AI laat zien hoe veldgewassen zich ontwikkelen:software kan toekomstige groei simuleren op basis van één enkel eerste beeld
- Welke informatie kan niet worden verkregen uit het Human Genome Project?
- Welke twee wetenschapper ontdekte deeltjes die de kern vormen?
- Wat is een homologe expressiesysteem?
- Wat is de studie van hoe een interne structuur van een organismen functioneert?
- Wat verwerven alle levende organismen van hun omgeving?
- Hoe slapende bacteriën weer tot leven komen
- Uitbreiding van het temperatuurbereik van lithium-ionbatterijen

- Nieuwe elektrokatalysatoren luiden koolstofneutraliteit in
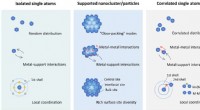
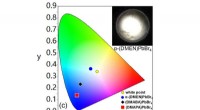
- Door de interne structuur van 2D-hybride perovskietmaterialen te wijzigen, zenden ze wit licht uit
- Hoe de geheimen van de tardigrade levensreddende medicijnen zoals insuline kunnen verbeteren

- Slimme stoffen mogelijk gemaakt door nieuwe metaaldepositietechniek

 Wat is het verschil tussen snelheid en snelheid?
Wat is het verschil tussen snelheid en snelheid?  Welke planeet is gestreept met kanalen en heeft vier inactieve vulkanen?
Welke planeet is gestreept met kanalen en heeft vier inactieve vulkanen?  Encryptie van kleurenafbeeldingen met een verbeterde versie van stream-codering en chaos
Encryptie van kleurenafbeeldingen met een verbeterde versie van stream-codering en chaos Wat is de PKA van natriumhydroxide?
Wat is de PKA van natriumhydroxide?  Wanneer verwarmd, wat is de gebalanceerde vergelijking van bariumchloraat ontleedt om chloride en zuurstofgas te vormen?
Wanneer verwarmd, wat is de gebalanceerde vergelijking van bariumchloraat ontleedt om chloride en zuurstofgas te vormen?  Soorten spijsverteringsenzymen
Soorten spijsverteringsenzymen  Hoe heeft de studie van zeebodem de theorie -plaattektoniek geholpen?
Hoe heeft de studie van zeebodem de theorie -plaattektoniek geholpen?  Sommige droogteperiodes tijdens de Indiase moesson zijn te wijten aan unieke verstoringen in de Noord-Atlantische Oceaan
Sommige droogteperiodes tijdens de Indiase moesson zijn te wijten aan unieke verstoringen in de Noord-Atlantische Oceaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

