
Wetenschap
Welke massa natrium is nodig om 108,2 g oxide te produceren?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie van natrium (Na) met zuurstof (O₂) produceert natriumoxide (Na₂o):
4 Na + o₂ → 2 na₂o
2. Bepaal de molaire massa van natriumoxide (Na₂o):
* NA:22,99 g/mol
* O:16.00 g/mol
Molaire massa van Na₂o =(2 * 22,99 g/mol) + (1 * 16.00 g/mol) =61,98 g/mol
3. Bereken de mol natriumoxide:
* Mol =massa / molaire massa
* Mol na₂o =108,2 g / 61,98 g / mol =1.746 mol
4. Gebruik de molverhouding van de gebalanceerde vergelijking om de mol natrium te vinden:
Uit de evenwichtige vergelijking zien we dat 4 mol NA reageert om 2 mol Na₂o te produceren. Daarom is de molverhouding 4:2 of 2:1.
* Mol na =(2/1) * 1.746 mol =3,492 mol
5. Bereken de massa natrium:
* Massa =mollen * molaire massa
* Massa van Na =3.492 mol * 22,99 g/mol = 80,3 g
Daarom heeft u 80,3 g natrium nodig om 108,2 g natriumoxide te produceren.
Hoofdlijnen
- NOAA bevestigt vierde wereldwijde koraalverblekingsgebeurtenis
- Eigenschap die de kans op een soort verbetert om te overleven?
- Wat gebruik je bij het meten van elektroforese?
- Hoe zou een dieren zijn extra opgeslagen suiker vrijgeven?
- Beschrijf de verschillende kenmerken van het leven?
- Hoeveel organen heeft een dierencel?
- Wat is het voordeel van binaire splijting voor prokaryoten die ze kunnen bestrijden. Variëren hun vormen. Pas gemakkelijk aan elke omgeving aan. zich snel voortplanten.
- Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?
- Wat was er eerst:de kip of het ei?
- Neutronen optimaliseren hoogrendementskatalysator voor groenere benadering van biobrandstofsynthese
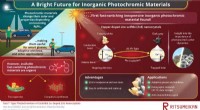
- Met koper gedoteerd zinksulfide verandert omkeerbaar van kleur wanneer het wordt verlicht en kan worden gebruikt in slimme adaptieve vensters
- Chemici ontwikkelen een eenvoudige, gebruiksvriendelijke methode om verontreinigende stoffen in water af te breken

- Gepulseerde elektronenbundels werpen licht op de productie van kunststoffen

- Machine learning-model voorspelt fenomeen dat essentieel is voor het begrijpen van materiaaleigenschappen

 Is Stratus Cloud High Middle of Low?
Is Stratus Cloud High Middle of Low?  Interkwartielbereik:IQR berekenen en visualiseren
Interkwartielbereik:IQR berekenen en visualiseren  Hoe vissers de vangbaarheid van vis veranderen
Hoe vissers de vangbaarheid van vis veranderen  Hoe verwijderen ongewervelde dieren afval die worden geproduceerd door cellen in hun lichaam?
Hoe verwijderen ongewervelde dieren afval die worden geproduceerd door cellen in hun lichaam?  Wat zijn de meest intense lichtbronnen in het universum?
Wat zijn de meest intense lichtbronnen in het universum?  Steden cooler maken is een no-brainer - dus waarom doen we er zo weinig aan?
Steden cooler maken is een no-brainer - dus waarom doen we er zo weinig aan? Trump v. Clinton:hoe je het laatste presidentiële debat kunt streamen
Trump v. Clinton:hoe je het laatste presidentiële debat kunt streamen  Kan zout een vuur heter laten branden?
Kan zout een vuur heter laten branden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


