
Wetenschap
Hoe verschillen zure hydrogenen van niet-zure hydrogenen?
Zure hydrogenen:
* Definitie: Hydrogenen die relatief eenvoudig te verwijderen zijn als een proton (H⁺) wanneer het molecuul interageert met een basis. Dit resulteert in de vorming van een stabiele conjugaatbasis.
* kenmerken:
* bevestigd aan elektronegatieve atomen: Zure hydrogenen zijn typisch gebonden aan atomen die zeer elektronegatief zijn, zoals zuurstof (O), stikstof (N) of halogenen (F, CL, BR, I). Deze elektronegatieve atomen trekken elektronendichtheid weg van de waterstof, waardoor het eerder als proton vertrekt.
* Resonantiestabilisatie: De resulterende conjugaatbasis profiteert vaak van resonantie -stabilisatie, het verspreiden van de negatieve lading en het stabieler maken.
* inductief effect: Elektronen-withending groepen in de buurt van de waterstof kunnen het ook zuurder maken door de elektronendichtheid rond de waterstof verder te verminderen.
* Voorbeelden:
* De waterstof in carbonzuren (R-COOH) is zuur vanwege het elektronegatieve zuurstofatoom.
* De hydrogenen in alcoholen (R-OH) en fenolen (AR-OH) zijn ook zuur.
* Sommige hydrogenen in aldehyden, ketonen en amiden kunnen zuur zijn, afhankelijk van het molecuul.
Niet-zuurige hydrogenen:
* Definitie: Hydrogenen die niet gemakkelijk als protonen worden verwijderd. Ze zijn strak gebonden aan het molecuul en worden niet gemakkelijk gedoneerd.
* kenmerken:
* bevestigd aan minder elektronegatieve atomen: Ze zijn meestal gebonden aan minder elektronegatieve atomen zoals koolstof (C) of waterstof (H).
* Gebrek aan resonantiestabilisatie: De geconjugeerde basis gevormd door het verwijderen van het proton ervaart geen significante resonantie -stabilisatie.
* inductief effect: Elektronen-donerende groepen in de buurt van de waterstof kunnen de zuurgraad verder verminderen.
* Voorbeelden:
* De hydrogenen in alkanen (R-H) zijn over het algemeen niet-zuur.
* De hydrogenen in alkenen en alkynes zijn ook meestal niet-zuur.
Key Takeaway: De zuurgraad van een waterstof wordt bepaald door de stabiliteit van de resulterende conjugaatbasis. Hoe stabieler de conjugaatbasis, hoe zure de waterstof.
Visualiseren van het verschil:
Stel je een touwtrekken voor.
* Zure waterstof: Het elektronegatieve atoom trekt de waterstof naar zich toe, waardoor het gemakkelijker is om als proton te verwijderen.
* Niet-zuurige waterstof: De waterstof is nauwer gebonden aan het atoom, waardoor het moeilijker is om te verwijderen.
Laat het me weten als je meer specifieke voorbeelden of verdere uitleg wilt!
 Welke ionen zullen de zuren en basen in water vormen?
Welke ionen zullen de zuren en basen in water vormen?  Hoe gebruik je moleculen in een zin?
Hoe gebruik je moleculen in een zin?  Welke twee dingen zijn er in aanvulling op water en koolstofdioxide nodig voor fotosynthese?
Welke twee dingen zijn er in aanvulling op water en koolstofdioxide nodig voor fotosynthese?  De verschillen tussen HPLC en GC
De verschillen tussen HPLC en GC Onderzoekers ontdekken nieuwe manier om fotonen te splitsen en op te tellen met silicium
Onderzoekers ontdekken nieuwe manier om fotonen te splitsen en op te tellen met silicium
 Door studenten geleide permacultuurtuinen van UMass Amherst dienen als model voor duurzame landbouw
Door studenten geleide permacultuurtuinen van UMass Amherst dienen als model voor duurzame landbouw NASA's CloudSat beëindigt de missie door in het hart van de wolken te turen
NASA's CloudSat beëindigt de missie door in het hart van de wolken te turen  Verontrustend nieuw onderzoek toont aan dat warm water naar de grootste ijskap ter wereld op Antarctica stroomt
Verontrustend nieuw onderzoek toont aan dat warm water naar de grootste ijskap ter wereld op Antarctica stroomt Hoeveel biomassa groeit er in de savanne?
Hoeveel biomassa groeit er in de savanne? Gelijktijdig gebruik van water en stikstof kan de duurzaamheid vergroten
Gelijktijdig gebruik van water en stikstof kan de duurzaamheid vergroten
Hoofdlijnen
- Hoeveel chromosomen zitten er in een gamete?
- Wat gebeurt er tijdens het transcriptieproces?
- Die eenzame, steile gomboom op een boerderij? Het is een reddingslijn voor koala's
- Giftige Death Cap-paddenstoel verspreidt zich over Noord-Amerika
- Synthetisch organel laat zien hoe kleine plasorganen in onze cellen werken
- Waarom kikkers verloren ledematen zoals axolotls niet kunnen regenereren
- Wat is de naam van de persoon die studies heeft uitgevonden?
- Wat is de bijnaam voor chromosomen?
- Wat is Greeces Biome?
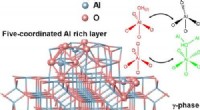
- Aard van vijf-gecoördineerd aluminium op γ-Al2O3-oppervlak
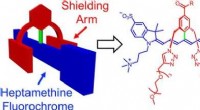
- Stabiele en functionele kleurstoffen voor nabij-infrarood fluorescentiebeeldvorming van levende onderwerpen
- Hygroscopische polymere gels:het verzamelen van zoet water en energie uit luchtvochtigheid
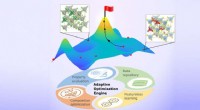
- Nieuwe aanpak bepaalt optimale materiaalontwerpen met minimale gegevens
- Stabiliserende zilverfilms voor zeer efficiënte brandstofcellen

 Veilige gegevensbescherming in het nieuwe internet der dingen
Veilige gegevensbescherming in het nieuwe internet der dingen Welke vorm beschrijft het beste de baan rond de zon?
Welke vorm beschrijft het beste de baan rond de zon?  Wanneer de temperatuur daalt, kan de Wator -damp veranderen?
Wanneer de temperatuur daalt, kan de Wator -damp veranderen?  Welke mach 0,80 tot mijl?
Welke mach 0,80 tot mijl?  Hoe een steen uit de Bronstijd een 'schatkaart' werd voor onderzoekers
Hoe een steen uit de Bronstijd een 'schatkaart' werd voor onderzoekers  Wat maakt de zon een ideale ster voor het leven?
Wat maakt de zon een ideale ster voor het leven?  Waarom is het belangrijk om de biodiversiteit te beschermen?
Waarom is het belangrijk om de biodiversiteit te beschermen?  Ceriumoxide-nanodeeltjes kunnen de prognose van hepatocellulair carcinoom verbeteren
Ceriumoxide-nanodeeltjes kunnen de prognose van hepatocellulair carcinoom verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

