
Wetenschap
Wat is de totale spanning voor een redoxreactie met halve reacties Ag E en Cu2 2e?
1. Identificeer de halfreacties
* reductie: AG
* oxidatie: Cu → Cu
2+
+ 2e
-
(Deze halfreactie verliest elektronen)
2. Zoek standaardreductiepotentialen op
U hebt een tabel met standaardreductiepotentialen (E °) nodig om de waarden voor elke halfreactie te vinden. Hier is een typisch voorbeeld:
* Ag
* Cu
2+
+ 2e
-
→ Cu e ° =+0.34 V
3. Bepaal het celpotentieel
* De reactie met de hogere E ° -waarde is de reductie. In dit geval, Ag
* De reactie met de lagere E ° -waarde is de oxidatie. In dit geval cu → cu
om het totale celpotentiaal te berekenen (E ° cel ), trek het standaardreductiepotentieel van de oxidatiehalfreactie af van het standaardreductiepotentieel van de reductiehalfreactie.
E ° cel =E ° reductie - E ° oxidatie
E ° cel =+0.80 V - (+0.34 V)
E ° cel =+0.46 V
Daarom is de totale spanning voor deze redoxreactie +0,46 v.
belangrijke opmerkingen:
* spontaniteit: Een positief celpotentiaal (zoals we berekend) geeft aan dat de reactie spontaan is onder standaardomstandigheden.
* Standaardomstandigheden: Deze berekening veronderstelt de standaardomstandigheden van 25 ° C en 1 atm druk.
* balanceren: Zorg ervoor dat het aantal verkregen elektronen in de reductiehalfreactie gelijk is aan het aantal verloren elektronen in de oxidatiehalfreactie. Mogelijk moet u een of beide halfreacties vermenigvuldigen met een factor om dit te bereiken.
 Verbetering van de efficiëntie, helderheid van perovskiet-LED's
Verbetering van de efficiëntie, helderheid van perovskiet-LED's Wat zijn twee of meer stoffen die samen, maar niet combineren om een nieuwe pure stof te vormen?
Wat zijn twee of meer stoffen die samen, maar niet combineren om een nieuwe pure stof te vormen?  Chloride -ion en het chlooratoom hebben hoeveel elektronenconfiguraties?
Chloride -ion en het chlooratoom hebben hoeveel elektronenconfiguraties?  Is goud een samengesteld element homo of hetero?
Is goud een samengesteld element homo of hetero?  Spinazie gebruikt in neutronenstudies zou het geheim kunnen ontrafelen voor een sterkere plantengroei
Spinazie gebruikt in neutronenstudies zou het geheim kunnen ontrafelen voor een sterkere plantengroei
Hoofdlijnen
- Hoe Venus Flytraps werken
- Soorten in het noorden zijn kwetsbaarder voor klimaatverandering
- Waar komt ATP -synthese voor in mitochondria?
- Wat zijn de drie brede wetenschapsafdelingen?
- Hoe maken cellen orgaansystemen?
- Vergelijk en vergelijk DNA & RNA
- Wat zijn de interacties tussen orgaansystemen?
- Waarom sommige genen sterk tot expressie komen
- Hoe een interne lichaamsklok spoelwormen vrijhoudt van constipatie
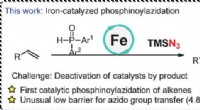
- PcFe-gekatalyseerde radicale fosfinoylazidatie van alkenen met een snelle azido-overdrachtsstap
- Cholesterol helpt het griepvirus te ontsnappen door het membraan van de gastheercel
- Tikken geheimen van Aussie spiders unieke zijde

- Ontwikkeling van magnetische koelmaterialen die efficiënte waterstofliquefactie mogelijk maken

- Zoutoplossing produceert betere organische elektrochemische transistors
 Is koper beter dan tin als geleider?
Is koper beter dan tin als geleider?  Robotchemicus ontdekt nieuwe moleculen en reacties
Robotchemicus ontdekt nieuwe moleculen en reacties Waarom werken alle orgelsystemen met elkaar?
Waarom werken alle orgelsystemen met elkaar?  nieuwe wegen, betere biobrandstoffen
nieuwe wegen, betere biobrandstoffen Wat zijn enkele meisjesnamen van de natuur?
Wat zijn enkele meisjesnamen van de natuur?  Hoe vuurwerk werkt
Hoe vuurwerk werkt  Wat is de uniformitaire verklaring voor hoe de meeste sedimentaire rotsen zijn gevormd?
Wat is de uniformitaire verklaring voor hoe de meeste sedimentaire rotsen zijn gevormd?  Hoe zijn mensen vergelijkbaar met sterren?
Hoe zijn mensen vergelijkbaar met sterren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

