
Wetenschap
Hoe bindt een natriumatoom een binding met chlooratoom?
Inzicht in de basis
* natrium (NA): Natrium heeft één elektron in zijn buitenste schaal (valentieschaal). Het wil dit elektron verliezen om een stabiele, volledige buitenste schaal te bereiken zoals de edelgassen.
* chloor (CL): Chloor heeft zeven elektronen in zijn valentieschil. Het wil één elektron krijgen om zijn buitenste schaal te voltooien.
De ionische bindingsvorming
1. Elektronenoverdracht: Het natriumatoom brengt zijn enkele valentie -elektron over naar het chlooratoom.
2. ionenvorming:
* Natrium, nadat hij een elektron heeft verloren, heeft nu een positieve lading en wordt een natriumion (Na+).
* Chloor, na een elektron te hebben gewonnen, heeft nu een negatieve lading en wordt een chloride-ion (Cl-).
3. Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen trekken elkaar sterk aan en vormen een ionische binding.
Het resultaat:natriumchloride (NaCl)
De resulterende verbinding, natriumchloride, wordt bij elkaar gehouden door de elektrostatische aantrekkingskracht tussen de positief geladen natriumionen en de negatief geladen chloride -ionen. Deze aantrekkingskracht is erg sterk, waardoor natriumchloride zijn karakteristieke hoge smeltpunt en sterke kristallijne structuur zijn.
Visuele weergave
U kunt dit proces als volgt visualiseren:
* Na (Eén elektron in de buitenste schaal) + Cl (zeven elektronen in de buitenste schaal)
* Na+ (lege buitenste schaal) + CL- (Volledige buitenste schaal) -> NaCl (ionische binding)
Key Points
* Ionische bindingen omvatten de overdracht van elektronen, wat resulteert in de vorming van ionen.
* De elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen is de drijvende kracht achter de vorming van ionische binding.
* Ionische verbindingen zijn typisch vaste stoffen bij kamertemperatuur en hebben hoge smeltpunten.
Laat het me weten als je nog andere vragen hebt.
 Ingenieurs bouwen chemisch aangedreven wielen die veranderen in tandwielen om mechanisch werk uit te voeren
Ingenieurs bouwen chemisch aangedreven wielen die veranderen in tandwielen om mechanisch werk uit te voeren Wat is droge zuurdepositie?
Wat is droge zuurdepositie?  Wat is het woordvergelijking voor magnesiumoxide plus zoutzuur?
Wat is het woordvergelijking voor magnesiumoxide plus zoutzuur?  Hoeveel moleculen zitten er in koolmonoxide?
Hoeveel moleculen zitten er in koolmonoxide?  Een vloeistof met een vaste vaste oplossing wordt oplossing genoemd, hoe kunt u terugkomen uit de oplossing?
Een vloeistof met een vaste vaste oplossing wordt oplossing genoemd, hoe kunt u terugkomen uit de oplossing?
 Feds ronden plan af om Alaskas Arctic National Wildlife Refuge open te stellen voor olieboringen
Feds ronden plan af om Alaskas Arctic National Wildlife Refuge open te stellen voor olieboringen Vulkaan Hawaï kan rotsblokken ter grootte van koelkasten uitspuwen
Vulkaan Hawaï kan rotsblokken ter grootte van koelkasten uitspuwen Wat zijn 10 levende wezens die in een bos leven?
Wat zijn 10 levende wezens die in een bos leven?  Wat is een schoenmackboom?
Wat is een schoenmackboom?  Vegetatiegroei op het noordelijk halfrond wordt belemmerd door waterbeperkingen in een opwarmend klimaat
Vegetatiegroei op het noordelijk halfrond wordt belemmerd door waterbeperkingen in een opwarmend klimaat
Hoofdlijnen
- Hoe wordt de mannelijke sekscel uit een pollenkorrel genoemd?
- Onderzoek onthult hoe Salmonella de immuunreactie van het lichaam vermijdt
- Hallo? Facebook lanceert telefoonapp voor Android
- Wat zijn enkele voorbeelden van dierlijke hulpbronnen?
- Wat zijn voorbeelden van symbiose -concurrentie en predatie in organismen?
- Wordt de microvilli gevonden in een plant- of dierencel?
- Welke organen in uw buik zijn solide?
- Lang of kort? Dik dun? Onderzoek toont aan dat veel factoren de arm- en beenomvang beïnvloeden
- Waarom is het mogelijk om een DNA -sequentie te gebruiken die bacteriën identificeren?
- Elektrische velden in kaart brengen om te helpen ontrafelen hoe enzymen werken
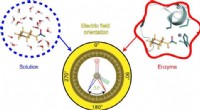
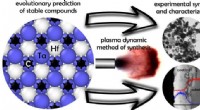
- Voordelige synthese van carbidematerialen met een hoog smeltpunt
- Elektronenversnellers onthullen de radicale geheimen van antioxidanten

- Bibliotheek met spinnenzijde kan geheimen bevatten voor nieuwe materialen

- Nieuwe 3D-printtechniek produceert levende 4D-materialen

 Wat zijn de mineralen van Haïti?
Wat zijn de mineralen van Haïti?  Oceanen:ze vervuilen, ze betalen
Oceanen:ze vervuilen, ze betalen Welke krater is bijna een mijl breed en werd gevormd door meteoroïde die 45 meter breed?
Welke krater is bijna een mijl breed en werd gevormd door meteoroïde die 45 meter breed?  Wat is de primaire kracht waardoor de zeebodem zich verspreidt?
Wat is de primaire kracht waardoor de zeebodem zich verspreidt?  Hanergy kondigt Fraunhofer-labclassificatie aan voor zonneproductiemodule met record conversie-efficiëntie
Hanergy kondigt Fraunhofer-labclassificatie aan voor zonneproductiemodule met record conversie-efficiëntie Luchtverspreidingsmodellen voor geurbeoordeling
Luchtverspreidingsmodellen voor geurbeoordeling Lijst met Hadal Zone Animals
Lijst met Hadal Zone Animals Wetenschappers imiteren de natuur om nanofilms te maken
Wetenschappers imiteren de natuur om nanofilms te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

