
Wetenschap
Waarom is chloor reactiever dan zwavel?
1. Elektronegativiteit: Chloor heeft een hogere elektronegativiteit dan zwavel (3,16 versus 2,58). Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding. De hogere elektronegativiteit van chloor betekent dat het een sterkere trek heeft op gedeelde elektronen, waardoor het waarschijnlijker is om elektronen te krijgen en negatieve ionen te vormen.
2. Elektronenaffiniteit: Chloor heeft een hogere elektronenaffiniteit dan zwavel. Elektronenaffiniteit is de verandering in energie wanneer een elektron wordt toegevoegd aan een neutraal atoom in de gasvormige toestand. De hogere elektronenaffiniteit van chloor betekent dat het meer energie vrijgeeft wanneer het een elektron krijgt, waardoor het voor chloor gunstiger wordt om elektronen te krijgen.
3. Ionisatie -energie: Chloor heeft een hogere ionisatie -energie dan zwavel. Ionisatie -energie is de minimale energie die nodig is om een elektron uit een gasvormige atoom te verwijderen. De hogere ionisatie -energie van chloor maakt het moeilijker om een elektron te verwijderen, wat betekent dat het minder snel elektronen verliest en positieve ionen vormt.
4. Atomic Grootte: Chloor is kleiner dan zwavel. De kleinere maat chloor maakt zijn buitenste elektronen meer aangetrokken tot de kern, waardoor het reactiever wordt.
5. Aantal valentie -elektronen: Chloor heeft zeven valentie -elektronen, terwijl zwavel er zes heeft. Chloor hoeft slechts één elektron te krijgen om een stabiel octet te bereiken, waardoor het reactiever is in het verkrijgen van elektronen in vergelijking met zwavel die twee elektronen moet krijgen.
Samenvattend: Chloor's hogere elektronegativiteit, elektronenaffiniteit, ionisatie -energie, kleinere atoomgrootte en behoefte aan slechts één elektron om een stabiel octet te bereiken, dragen allemaal bij aan de hogere reactiviteit in vergelijking met zwavel.
 Onderzoekers vinden bewijs van eiwitvouwing op de plaats van intracellulaire druppeltjes
Onderzoekers vinden bewijs van eiwitvouwing op de plaats van intracellulaire druppeltjes Wat gebeurt er als een stof in water oplost?
Wat gebeurt er als een stof in water oplost?  Hoe beïnvloedt het mengen van een vaste stof en vloeistof de totale mengmassa?
Hoe beïnvloedt het mengen van een vaste stof en vloeistof de totale mengmassa?  Wat is de gebalanceerde formule voor NaCl?
Wat is de gebalanceerde formule voor NaCl?  Wat zou er gebeuren als het verhogen van de zoutconcentratie in een oplossing?
Wat zou er gebeuren als het verhogen van de zoutconcentratie in een oplossing?
 New England kent de winter, maar waarom zo gevaarlijk koud?
New England kent de winter, maar waarom zo gevaarlijk koud?  Wereldwijde ecologische voetafdruk van toerisme gekwantificeerd in wereldprimeur
Wereldwijde ecologische voetafdruk van toerisme gekwantificeerd in wereldprimeur Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat
Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat Alles wat je ooit wilde weten over bloedzuigerseks, maar niet durfde te vragen
Alles wat je ooit wilde weten over bloedzuigerseks, maar niet durfde te vragen De natuur beschermen de beste manier om de planeet koel te houden:rapport
De natuur beschermen de beste manier om de planeet koel te houden:rapport
Hoofdlijnen
- Wat is een type menselijke cel dat geen kern heeft?
- RNA en andere moleculen laten de kern door de structuur geroepen?
- Hoe verschilt de nucleaire sequentie van coderingsstreng een DNA -molecuul van geproduceerde RNA?
- Wat zijn voorbeelden van echte wetenschappelijke onderzoeken en bijvoorbeeld waarom deze als wetenschap worden beschouwd?
- Hoe heet het geslacht voor een kruidnagel?
- Wat is het verschil tussen fotosy thisis en cellulaire ademhaling?
- Waarom is het belangrijk om classiteitsorganismen te zijn?
- Wat doodt zeeotters? Wetenschappers lokaliseren parasietstam
- Waarom gebruikte Mendel alle hoge planten in zijn F1 -experiment?
- Nieuwe slimme sensor kan een revolutie teweegbrengen in de preventie van misdaad en terrorisme

- Chemici kenmerken de dodelijke schimmel onder ons
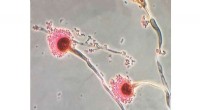
- Lasers gebruiken om moleculaire mysteries in onze atmosfeer te visualiseren

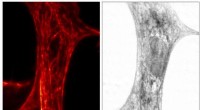
- Onderzoekers vinden bewijs van eiwitvouwing op de plaats van intracellulaire druppeltjes

- Gecombineerde röntgen- en fluorescentiemicroscoop onthult onzichtbare moleculaire details
 Dubbel gedoteerde koolstofmicrosferen met sterk stikstof en zwavel voor supercondensatoren
Dubbel gedoteerde koolstofmicrosferen met sterk stikstof en zwavel voor supercondensatoren Alcohol omzetten in belangrijke ingrediënten voor nieuwe medicijnen
Alcohol omzetten in belangrijke ingrediënten voor nieuwe medicijnen Rode superreuzen borrelen en schuimen zo hard dat hun positie in de lucht rond lijkt te dansen
Rode superreuzen borrelen en schuimen zo hard dat hun positie in de lucht rond lijkt te dansen Wat is de hoogte van Keystone Colorado?
Wat is de hoogte van Keystone Colorado?  Hebben rivieren de evolutie van Sumatraanse cascadekikkers beïnvloed?
Hebben rivieren de evolutie van Sumatraanse cascadekikkers beïnvloed?  Klimaatverandering maakt Amerikaanse bergmeren groen van algen
Klimaatverandering maakt Amerikaanse bergmeren groen van algen Hoeveel jaar duurt elke planeet om rond de zon te draaien?
Hoeveel jaar duurt elke planeet om rond de zon te draaien?  Waar is lichaamsvet van gemaakt?
Waar is lichaamsvet van gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

