
Wetenschap
Waarom komt de reactie van ijzer en koperchloride voor?
Hier is de uitsplitsing:
* IJzer (Fe) is meer reactiever dan koper (Cu). Dit betekent dat ijzer een sterkere neiging heeft om elektronen te verliezen en positieve ionen te vormen.
* koperchloride (CUCL₂) bevat koperionen (cu²⁺).
* Wanneer ijzer wordt toegevoegd aan een koperchloride -oplossing, verplaatst het meer reactief ijzer het minder reactieve koper. IJzeratomen verliezen elektronen en vormen ijzer (II) ionen (Fe²⁺) en de koperionen krijgen elektronen om koperatomen te worden (Cu).
Dit wordt weergegeven door de volgende chemische vergelijking:
Fe (s) + Cucl₂ (aq) → fecl₂ (aq) + cu (s)
Sleutelpunten:
* De reactie is spontaan omdat het energie vrijgeeft (exotherme).
* je zult observeren Een roodbruine vaste stof (koper) vormt zich op het oppervlak van het ijzer naarmate de reactie vordert. De oplossing verandert ook van kleur wanneer het ijzeren chloride zich vormt.
Deze reactie is een klassiek voorbeeld van hoe reactiviteitsreeksen kunnen worden gebruikt om de uitkomst van chemische reacties te voorspellen.
 Wat is het verschil tussen een oplossing en een mechanisch mengsel?
Wat is het verschil tussen een oplossing en een mechanisch mengsel?  Is ammoniumethanoaat een zuur of een base?
Is ammoniumethanoaat een zuur of een base?  Leg uit waarom bijna alle vaste stoffen dichter zijn dan hun vloeibare toestanden door te beschrijven wat er op moleculair niveau gebeurt?
Leg uit waarom bijna alle vaste stoffen dichter zijn dan hun vloeibare toestanden door te beschrijven wat er op moleculair niveau gebeurt?  Wat zijn de eigenschappen van sulferdioxide?
Wat zijn de eigenschappen van sulferdioxide?  Eilanden zonder structuur in metaallegeringen kunnen leiden tot hardere materialen
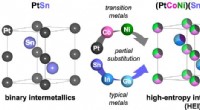
Eilanden zonder structuur in metaallegeringen kunnen leiden tot hardere materialen
 Klimaatverandering, vervuiling en verstedelijking bedreigen het water in Canada
Klimaatverandering, vervuiling en verstedelijking bedreigen het water in Canada Keniaanse boeren proosten op groeiende vraag Europese vraag naar avocado's
Keniaanse boeren proosten op groeiende vraag Europese vraag naar avocado's Biodiverse bossen beter in staat koolstof voor lange periodes op te slaan, zegt studie
Biodiverse bossen beter in staat koolstof voor lange periodes op te slaan, zegt studie Hoe u het geven van cadeaus voor de feestdagen milieuvriendelijker en zinvoller kunt maken?
Hoe u het geven van cadeaus voor de feestdagen milieuvriendelijker en zinvoller kunt maken? Onderzoek toont potentieel aan voor minder methaan bij koeien
Onderzoek toont potentieel aan voor minder methaan bij koeien
Hoofdlijnen
- Hoe een microscoop te gebruiken om cellen te zien
- Onderzoek onderzoekt hoe de oppervlakken van borstimplantaten de immuunrespons beïnvloeden
- Reproduceren kikkers zich aseksueel of seksueel?
- Wat zijn drie soorten wetenschappelijke modellen?
- Zien is geloven:wetenschappers onthullen connectoom van het visuele systeem van de fruitvlieg
- Hoe heet het als twee verschillende wezens worden samengevoegd?
- Hoeveel chromosomen in slangen?
- Wat is de rol van calcereerklieren in de regenworm?
- Welke individuen zullen het meest waarschijnlijk overleven en zich voortplanten zijn die?
- Elektrisch geleidende verven en andere polymeerlegeringen nu gemakkelijk te produceren

- Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders

- Meegaan met de DNA-stroom:molecuul van het leven vindt nieuwe toepassingen in micro-elektronica

- Koolstofneutraliserende propyleenproductie katalyseert verandering in petrochemische technologie
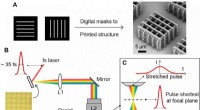
- Nieuwe techniek verhoogt 3D-printsnelheid met 1, 000 tot 10, 000 keer
 Wat betekent het om de grond gebonden te zijn?
Wat betekent het om de grond gebonden te zijn?  Het membraan in membraanloze organellen begrijpen
Het membraan in membraanloze organellen begrijpen Deep learning toepassen op motion capture met DeepLabCut
Deep learning toepassen op motion capture met DeepLabCut NASA ziet tropische cycloon Carlos boven La Reunion en Mauritius
NASA ziet tropische cycloon Carlos boven La Reunion en Mauritius Vuurstormen en vlammende tornado's:hoe bosbranden hun eigen woeste weersystemen creëren
Vuurstormen en vlammende tornado's:hoe bosbranden hun eigen woeste weersystemen creëren Is natuurlijke selectie een proces of resultaat van het proces?
Is natuurlijke selectie een proces of resultaat van het proces?  Hoe beïnvloeden verschillende oppervlakken snelheid?
Hoe beïnvloeden verschillende oppervlakken snelheid?  Wetenschapper legt uit waarom Jupiters maan Europa energetische vloeibare oceanen zou kunnen hebben
Wetenschapper legt uit waarom Jupiters maan Europa energetische vloeibare oceanen zou kunnen hebben
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

