
Wetenschap
Waarom is ammoniak meer oplosbaar dan koolstoftetrachloride?
1. Waterstofbinding:
* ammoniak: Ammoniak kan waterstofbruggen vormen met watermoleculen. Het stikstofatoom in ammoniak heeft een eenzaam paar elektronen, dat een waterstofbinding kan vormen met het gedeeltelijk positieve waterstofatoom van water.
* Koolstoftetrachloride: Koolstoftetrachloride kan geen waterstofbruggen vormen. Het koolstofatoom wordt omgeven door vier chlooratomen, die zeer elektronegatief zijn, waardoor het koolstofatoom enigszins positief is. De chlooratomen zijn echter te elektronegatief om waterstofbruggen te vormen.
2. Polariteit:
* ammoniak: Ammoniak is een polair molecuul. Het stikstofatoom heeft een eenzaam paar elektronen, waardoor het enigszins negatief is, terwijl de waterstofatomen enigszins positief zijn.
* Koolstoftetrachloride: Koolstoftetrachloride is een niet -polair molecuul. De tetraëdrische vorm en symmetrische verdeling van chlooratomen resulteren in gelijk delen van elektronen, wat leidt tot geen netto dipoolmoment.
3. "Zoals oplost zoals":
* Water is een polair oplosmiddel en de polariteit van ammoniak maakt het in staat om gemakkelijk op te lossen in water.
* Koolstoftetrachloride is niet -polair en lost daarom niet goed op in water. In plaats daarvan zou het oplossen in niet -polaire oplosmiddelen zoals hexaan of benzeen.
Samenvattend:
Het vermogen van ammoniak om waterstofbindingen te vormen met water, de polariteit en het "zoals oplost zoals" principe dragen allemaal bij aan de hoge oplosbaarheid in water in vergelijking met koolstoftetrachloride.
 Wat staat er in het verschiet voor de wereldwijde CO2-uitstoot?
Wat staat er in het verschiet voor de wereldwijde CO2-uitstoot? Ruwheid en concentriciteit:in stadsplanning, kijk naar de randen, niet alleen de kern
Ruwheid en concentriciteit:in stadsplanning, kijk naar de randen, niet alleen de kern Uit nieuwe studie blijkt dat timing de sleutel is om organisch materiaal in natte bodems te houden
Uit nieuwe studie blijkt dat timing de sleutel is om organisch materiaal in natte bodems te houden Wat gebeurt er als een bevolking wordt uitgedaagd door de veranderende omgevingscondities?
Wat gebeurt er als een bevolking wordt uitgedaagd door de veranderende omgevingscondities?  Energieverbruik Amerikanen stijgt ondanks bezorgdheid over klimaatverandering
Energieverbruik Amerikanen stijgt ondanks bezorgdheid over klimaatverandering
Hoofdlijnen
- Cultuur kan verklaren waarom hersenen groter zijn geworden
- De loonkloof in de wetenschap:genderdiscriminatie?
- Welk meercellig?
- Welke verdeling brengt impulsen over van het centrale zenuwstelsel naar spieren of klieren?
- Nieuwe procedure voor snellere detectie van milieueffecten van zalmkwekerijen
- Waarom hebben eencellige organismen verschillende structuren van elkaar?
- Wat is de laatste evolutie van Dragonoid?
- Wat is het fenomeen engelenhaar?
- Atomair zicht op cellulaire pomp laat zien hoe bacteriën eiwitten uitzenden
- Nanokristallen worden beter als ze verdubbelen met MOF's

- Nieuwe methode kan scheuren in metaal opsporen lang voordat ze catastrofes veroorzaken

- Nieuwe katalysatoren maken van unieke metaallegeringen
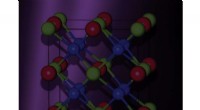
- Zinkoxide:sleutelcomponent voor de methanolsynthesereactie op koperkatalysatoren
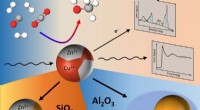
- Rek en vloei:onderzoek werpt licht op ongebruikelijke eigenschappen van bekende materialen
 Wat markeert de buitenste grens van uw zonnestelsel?
Wat markeert de buitenste grens van uw zonnestelsel?  Lijst van 20 taprotplanten met hun wetenschappelijke en lokale namen?
Lijst van 20 taprotplanten met hun wetenschappelijke en lokale namen?  Onderzoekers gebruiken speltheorie om beleidsmakers te helpen bij het opstellen van aansprakelijkheidsregels voor ongevallen met zelfrijdende auto's
Onderzoekers gebruiken speltheorie om beleidsmakers te helpen bij het opstellen van aansprakelijkheidsregels voor ongevallen met zelfrijdende auto's Drijvende windturbines in opmars
Drijvende windturbines in opmars Het onderzoeksecosysteem van Afrika heeft een cultuur van mentoring nodig
Het onderzoeksecosysteem van Afrika heeft een cultuur van mentoring nodig NIST-software helpt bij de analyse van geïnstrumenteerde charpy-tests
NIST-software helpt bij de analyse van geïnstrumenteerde charpy-tests Hoe kracht, kracht, koppel en energie werken
Hoe kracht, kracht, koppel en energie werken  Standaard waterbehandelingstechniek verwijdert en inactiveert een omhuld virus
Standaard waterbehandelingstechniek verwijdert en inactiveert een omhuld virus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

