
Wetenschap
Waarom vormt helium geen verbindingen?
* Volledige valentie -shell: Helium heeft een gevulde 1s orbitale, met twee elektronen. Dit maakt het ongelooflijk stabiel, omdat het voldoet aan de octetregel en geen "wens" heeft om elektronen te winnen of te verliezen.
* Hoge ionisatie -energie: Het vereist een enorme hoeveelheid energie om een elektron uit de stabiele configuratie van Helium te verwijderen. Dit maakt het erg moeilijk om kationen te vormen (positief geladen ionen).
* Kleine atoommaat: De kleine grootte van Helium leidt tot een sterke aantrekkingskracht tussen zijn kern en elektronen, waardoor de stabiliteit verder wordt vergroot.
* Gebrek aan lege orbitalen: Helium mist lege orbitalen om elektronen van andere atomen te huisvesten. Dit maakt het uiterst moeilijk om covalente bindingen te vormen (elektronen delen).
Uitzonderingen:
Hoewel helium over het algemeen als niet -reactief wordt beschouwd, zijn er enkele zeer zeldzame en exotische uitzonderingen, zoals de vorming van:
* heliumhydride -ion (heh+) :Dit is een zeer onstabiele soort die alleen wordt waargenomen in extreem barre omstandigheden zoals het interstellaire medium.
Samenvattend: De uitzonderlijke stabiliteit van Helium vanwege zijn volledige valentieschil, hoge ionisatie -energie, kleine omvang en gebrek aan lege orbitalen maakt het extreem bestand tegen het vormen van verbindingen. Het is een edelgas, inhoud in zijn eigen staat en over het algemeen blij om gewoon te bestaan.
 Sommige bestaande geneesmiddelen tegen kanker kunnen gedeeltelijk werken door zich te richten op RNA, studie toont
Sommige bestaande geneesmiddelen tegen kanker kunnen gedeeltelijk werken door zich te richten op RNA, studie toont Methode om een synthetisch derivaat van natuurlijke indigo te maken, kan toekomstige elektronische apparaten inspireren
Methode om een synthetisch derivaat van natuurlijke indigo te maken, kan toekomstige elektronische apparaten inspireren  Wat is het product van KI plus H2SO4?
Wat is het product van KI plus H2SO4?  Hoeveel mol zwavel in 40 gram zwavel?
Hoeveel mol zwavel in 40 gram zwavel?  Waar wordt Carborane Superacid of HCHB11Cl11 voor gebruikt?
Waar wordt Carborane Superacid of HCHB11Cl11 voor gebruikt?
 Met klimaatverandering minder duidelijk in Midwest, parkbezoekers willen weten hoe lokale hulpbronnen worden beïnvloed
Met klimaatverandering minder duidelijk in Midwest, parkbezoekers willen weten hoe lokale hulpbronnen worden beïnvloed Lijst van dieren die Rabies
Lijst van dieren die Rabies Stijgt of daalt de luchtdruk wanneer het regent?
Stijgt of daalt de luchtdruk wanneer het regent?  Telescoop-vijanden binden samen, de weg naar de top van Hawaï blokkeren
Telescoop-vijanden binden samen, de weg naar de top van Hawaï blokkeren De EU moet zich aanpassen aan het opwarmende continent:ambtenaren
De EU moet zich aanpassen aan het opwarmende continent:ambtenaren
Hoofdlijnen
- De genetische wisselwerking bij valse meeldauw van Impatiens:een op transcriptoom gebaseerde benadering om de ziekteresistentie te verbeteren
- Wat zijn hyfen en wat is hun functie?
- Wat is erthrocyten?
- Onderzoekers ontdekken hoe zenuwcellen in de hersenen van vleermuizen reageren op hun omgeving en sociale interacties met andere vleermuizen
- Wat is het belangrijkste product van fotosynthese dat planten levend houdt?
- Ideeën voor celademhaling
- Hoe zoet het is:nieuw hulpmiddel voor het karakteriseren van plantensuikertransporteurs
- Wat is het verschil tussen anatomisch embryologisch en biochemisch bewijs?
- Wat is listeria? Een microbioloog legt de bacterie uit achter recente dodelijke uitbraken van voedselvergiftiging
- Strategische formulering van gewoon cement kan een grote impact hebben op de waterzuivering

- Snelle meting van aërosolvluchtigheid met behulp van een op deep learning gebaseerde draagbare microscoop

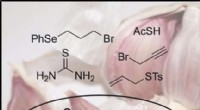
- Korte totale synthese van ajoen, een biologisch actieve component in olie-extracten van knoflook
- Nieuwe manier om naar celmembranen te kijken, kan de manier veranderen waarop we ziekten bestuderen
- Materiaal voor veiligere voetbalhelmen kan hoofdletsel verminderen

 Wanneer was de eerste maanlanding?
Wanneer was de eerste maanlanding?  Nieuwe optische nanosensor verbetert de nauwkeurigheid van het in kaart brengen van de hersenen, opent de weg voor meer toepassingen
Nieuwe optische nanosensor verbetert de nauwkeurigheid van het in kaart brengen van de hersenen, opent de weg voor meer toepassingen Een unieke geleidende toestand onder UV-straling
Een unieke geleidende toestand onder UV-straling Dingen die natuurgroen zijn?
Dingen die natuurgroen zijn?  Een object is alleen in beweging als de afstand van een referentiepunt is?
Een object is alleen in beweging als de afstand van een referentiepunt is?  Golfkarakter van gedelokaliseerde elektronen in defecte koolwaterstoffen aan de oorsprong van kosmische infraroodemissie
Golfkarakter van gedelokaliseerde elektronen in defecte koolwaterstoffen aan de oorsprong van kosmische infraroodemissie Wat zijn de patronen in het zonnestelsel?
Wat zijn de patronen in het zonnestelsel?  Welk weefsel covrs en lijnen vele delen van het lichaam?
Welk weefsel covrs en lijnen vele delen van het lichaam?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

