
Wetenschap
Wat is de empirische formule van een samengesteld uranium en fluor dat is samengesteld 67,6 procent 32,4 is?
1. Ga uit van een 100 g monster
* Dit maakt de berekeningen eenvoudiger. We hebben nu 67,6 g uranium (U) en 32,4 g fluor (F).
2. Converteer grams naar mollen
* Verdeel de massa van elk element door zijn molaire massa:
* uranium (u): 67,6 g / 238,03 g / mol =0,284 mol
* fluor (f): 32,4 g / 19,00 g / mol =1,71 mol
3. Vind de molverhouding
* Verdeel elke molwaarde door de kleinste molwaarde:
* uranium (u): 0,284 mol / 0,284 mol =1
* fluor (f): 1,71 mol / 0,284 mol =6,03 ≈ 6
4. Schrijf de empirische formule
* De molverhouding vertelt ons de eenvoudigste verhouding van het hele nummer van atomen in de verbinding.
* De empirische formule is uf₆ (Uranium hexafluoride).
 Hebben vaste stoffen een hoog of laag smeltpunt?
Hebben vaste stoffen een hoog of laag smeltpunt?  Wat is het product van dehydrogenatiebutaan?
Wat is het product van dehydrogenatiebutaan?  Waar is balpeninkt van gemaakt?
Waar is balpeninkt van gemaakt?  Sommige componenten van inkt worden minimaal aangetrokken tot de stationaire fase en zeer oplosbaar in oplosmiddel waar deze zich op filterpapier bevinden tijdens chromatografie?
Sommige componenten van inkt worden minimaal aangetrokken tot de stationaire fase en zeer oplosbaar in oplosmiddel waar deze zich op filterpapier bevinden tijdens chromatografie?  Welke elementen hebben zeven valance -elektronen?
Welke elementen hebben zeven valance -elektronen?
 Hoe sociale media kustgebieden helpen omgaan met de kracht van extreme stormen
Hoe sociale media kustgebieden helpen omgaan met de kracht van extreme stormen  Iedereen doet het, dus ik kan het ook:hoe het valse consensus-effect milieuschade veroorzaakt?
Iedereen doet het, dus ik kan het ook:hoe het valse consensus-effect milieuschade veroorzaakt? Hoe je genuanceerde details krijgt aan de top van de wereld
Hoe je genuanceerde details krijgt aan de top van de wereld Heeft Neptunus natuurlijke hulpbronnen?
Heeft Neptunus natuurlijke hulpbronnen?  Nieuw rapport:stand van de wetenschap over westerse bosbranden, bossen en klimaatverandering
Nieuw rapport:stand van de wetenschap over westerse bosbranden, bossen en klimaatverandering
Hoofdlijnen
- Wat is de wetenschappelijke naam voor organismen die diabetes veroorzaakt?
- Kan plastic gemaakt worden van algen?
- Veerkracht van tropische bossen tegen seizoensgebonden droogte, gekoppeld aan de beschikbaarheid van voedingsstoffen
- Hoe jasmonaatsignalering wordt verbeterd onder fosforarme omstandigheden in de plantenfysiologie
- Wat zijn de drie belangrijkste soorten rna?
- Heeft glucose een transporteiwit nodig?
- wat Eencellige organismen bestaan uit slechts één cel. Meercellig meer dan Welke levensfuncties kunnen zowel eencellige als meercellige organismen vervullen?
- Wat zijn de twee algemene categorieën waarin de studie van de wetenschap kan worden onderverdeeld?
- Wat is het deel van een cel dat heen en weer zwaait?
- Natuurkundigen werpen röntgenlicht op smeltende polymeren

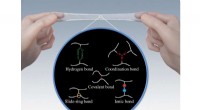
- Gecontroleerde fabricage van multimetalen bouwstenen voor hybride nanomaterialen

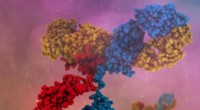
- Het bereik van therapeutische antilichamen vergroten
- Elastomeren ontwikkelen sterkere hechtingsbanden
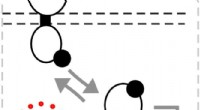
- Techniek om tweecomponenten biologische sensoren te finetunen
 Onderzoekers creëren instrument om snel te testen of medicijnen sporenkristalliniteit bevatten
Onderzoekers creëren instrument om snel te testen of medicijnen sporenkristalliniteit bevatten Ultradunne transistors voor snellere computerchips
Ultradunne transistors voor snellere computerchips Hoeveel weegt het leven?
Hoeveel weegt het leven? Wat hebben zeepbellen en vlinders met elkaar gemeen?
Wat hebben zeepbellen en vlinders met elkaar gemeen?  Protoplasma van de cellen eukaryoten is verdeeld in een afgeronde ... wat?
Protoplasma van de cellen eukaryoten is verdeeld in een afgeronde ... wat?  Waarom wordt er weinig warmte vastgehouden in de thermosfeer?
Waarom wordt er weinig warmte vastgehouden in de thermosfeer?  Onderzoek toont potentieel aan voor minder methaan bij koeien
Onderzoek toont potentieel aan voor minder methaan bij koeien Wat middeleeuwse skeletten ons vertellen over moderne pandemieën
Wat middeleeuwse skeletten ons vertellen over moderne pandemieën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

