
Wetenschap
Wat is het kookpunt van geconcentreerde waterige oplossing natriumchloride?
* Kookpunthoogte: Het toevoegen van een opgeloste stof (zoals NaCl) aan een oplosmiddel (zoals water) verhoogt het kookpunt van de oplossing. Dit fenomeen wordt kookpunthoogte genoemd.
* concentratie is belangrijk: Hoe hoger de concentratie van de opgeloste stof, hoe groter de toename van het kookpunt.
Om het kookpunt te berekenen, hebt u: nodig
1. De molaliteit van de oplossing: Molaliteit is het aantal mol opgeloste stof per kilogram oplosmiddel.
2. De molale kookpunthoogteconstante (KB) voor water: Deze waarde is 0,512 ° C/m.
formule:
* Δtb =kb * m
* Δtb =verandering in kookpunt
* Kb =molaal kookpunt hoogte constant
* m =molaliteit van de oplossing
Voorbeeld:
Laten we zeggen dat u een 1 molale (1 m) oplossing van NaCl hebt. De verandering in kookpunt zou zijn:
* Δtb =(0,512 ° C/m) * (1 m) =0,512 ° C
Omdat het normale kookpunt van water 100 ° C is, zou het kookpunt van de 1 m NaCl -oplossing zijn:
* 100 ° C + 0,512 ° C =100.512 ° C
Belangrijke opmerking: Deze berekening veronderstelt het ideale gedrag van de oplossing. In werkelijkheid kan de hoogte van het kookpunt enigszins anders zijn als gevolg van interacties tussen de ionen in de oplossing.
Laat het me weten als je de concentratie van de NaCl -oplossing hebt en ik kan je helpen het kookpunt te berekenen!
 Baanbrekende analyse laat zien hoe verschillende medicijnen een interactie aangaan met hetzelfde doelwit
Baanbrekende analyse laat zien hoe verschillende medicijnen een interactie aangaan met hetzelfde doelwit Wat is het gas dat wordt uitgestoten bij het verbranden van hout?
Wat is het gas dat wordt uitgestoten bij het verbranden van hout?  3D-beeldvormingsonderzoek onthult hoe atomen zijn verpakt in amorfe materialen
3D-beeldvormingsonderzoek onthult hoe atomen zijn verpakt in amorfe materialen Mechanische biologische behandeling van rioolwater?
Mechanische biologische behandeling van rioolwater?  Wat is Mg2CrO4?
Wat is Mg2CrO4?
Hoofdlijnen
- Welk systeem reguleert de groei van het metabolisme en de functies van seksuele organen?
- Hoe klonen werkt
- Gebruikt fotosynthese of cellulaire ademhaling suiker om engrey te maken?
- Simulaties laten zien hoe bèta-amyloïde neurale cellen kan doden
- Mitochondria is een voorbeeld van een?
- Hoe verzamelen wetenschappers informatie?
- Hoe reproduceren planten zich als ze zaadloos zijn?
- Wat is de vorm van locomotie univalen?
- Facebook of telefoontje? De gezinsdynamiek kan beslissend zijn
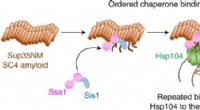
- Drie begeleiders coördineren het uiteenvallen van amyloïde fibrillen in gist
- Kenniskloof gedicht in ons begrip van degradatie van ethaan
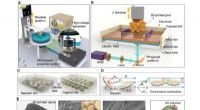
- 3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden
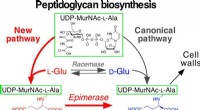
- Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen
- Nieuw leven inblazen in kleurstofgevoelige zonnecellen

 Oudere Neanderthaler overleefde met een beetje hulp van zijn vrienden
Oudere Neanderthaler overleefde met een beetje hulp van zijn vrienden Wat zou er met een blad gebeuren als het in een sterk geconcentreerde zoutoplossing zou worden geplaatst?
Wat zou er met een blad gebeuren als het in een sterk geconcentreerde zoutoplossing zou worden geplaatst?  Een strategie om de faseselectiviteit in de synthese van zeoliet met templates te beheersen
Een strategie om de faseselectiviteit in de synthese van zeoliet met templates te beheersen Wat is erthrocyten?
Wat is erthrocyten?  Hoeveel stop kan een stikstofatoom maken op zijn reis?
Hoeveel stop kan een stikstofatoom maken op zijn reis?  Wat is een niet -voorbeeld van chromosoom?
Wat is een niet -voorbeeld van chromosoom?  Wat is meer een pint of liter?
Wat is meer een pint of liter?  Wetenschappers synthetiseren nieuw, ultrahard materiaal
Wetenschappers synthetiseren nieuw, ultrahard materiaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

