
Wetenschap
Wat gebeurt er als u CUCL2 H2O AL toevoegt?
De reactie:
* aluminium (AL) is reactiever dan koper (Cu) . Dit betekent dat aluminium koper van zijn verbinding kan verplaatsen.
* cucl₂ · h₂o Lost in water op om koper (II) ionen (Cu²⁺) en chloride -ionen (CL⁻) te vormen.
* Het aluminium reageert met de koper (II) ionen, die aluminiumchloride (alcl₃) vormt en kopermetaal (Cu) .
chemische vergelijking:
3 Cucl₂ · H₂o + 2 Al → 2 Alcl₃ + 3 Cu + 6 H₂o
Observaties:
* U zult de vorming waarnemen van een roodbruine neerslag , dat is kopermetaal .
* De oplossing wordt kleurloos omdat het koper (II) ionen worden verbruikt.
* bubbels van waterstofgas kan worden gezien als een bijproduct van de reactie.
Belangrijke opmerking:
* Deze reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* De reactie wordt meestal uitgevoerd in een zure oplossing om het proces te versnellen.
Samenvattend resulteert de toevoeging van CUCL₂ · H₂o en Al aan water in een enkele verplaatsingsreactie waarbij aluminium koper uit de verbinding verplaatst, waardoor koperen metaal en aluminiumchloride wordt gevormd.
 Veranderingen in neerslagpatronen beïnvloeden natuurlijke selectie op wereldschaal
Veranderingen in neerslagpatronen beïnvloeden natuurlijke selectie op wereldschaal Onderzoek naar de mondiale voedselhandel ondermijnt de aannames over hoe het met de biodiversiteit gaat
Onderzoek naar de mondiale voedselhandel ondermijnt de aannames over hoe het met de biodiversiteit gaat  Vleugelen:hoe manoeuvreren vleermuizen hun prooi te slim af?
Vleugelen:hoe manoeuvreren vleermuizen hun prooi te slim af?  NASA observeert regenval van tornado-paaiende stormen in het zuiden van de VS
NASA observeert regenval van tornado-paaiende stormen in het zuiden van de VS Hoe overvloedig is boor?
Hoe overvloedig is boor?
Hoofdlijnen
- Wat is de naam van het ademhalingsorgaan van de regenwormen?
- Planten worden toleranter als ze in symbiose met schimmels leven
- Erven elk dier dezelfde mix van genen van zijn ouders?
- Wetenschappers zijn van mening dat AI een cruciale rol zal spelen bij het aanpakken van de biodiversiteitscrisis
- Kunnen mRNA-vaccins de veehouderij helpen stimuleren?
- Is iedereen geboren met natuurlijke immuniteit?
- Wat wordt pH beïnvloed?
- Op welke twee manieren beïnvloedt de mens de stikstofcyclus?
- Wat is een Sugardoodle?
- Bouwstenen van al het leven krijgen nieuw inzicht

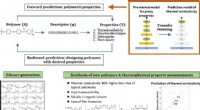
- Succesvolle toepassing van machine learning bij de ontdekking van nieuwe polymeren
- Wetenschappers ontdekken nieuw bacterieel resistentiemechanisme tegen peptide-antibiotica
- Video:De enige detox die je ooit nodig zult hebben

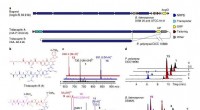
- Chemici ontwikkelen een veelbelovende methode voor medicijnsynthese
 Oorlog in Oekraïne benadrukt het groeiende strategische belang van particuliere satellietbedrijven
Oorlog in Oekraïne benadrukt het groeiende strategische belang van particuliere satellietbedrijven Nieuwe richtlijnen voor het reageren op cyberaanvallen gaan niet ver genoeg
Nieuwe richtlijnen voor het reageren op cyberaanvallen gaan niet ver genoeg Hoe verhoudt de versnelling van de zwaartekracht zich tussen objecten?
Hoe verhoudt de versnelling van de zwaartekracht zich tussen objecten?  Waarom zou de buffer weerstand bieden tegen verandering in PH als er een kleine hoeveelheid zuur of base wordt toegevoegd?
Waarom zou de buffer weerstand bieden tegen verandering in PH als er een kleine hoeveelheid zuur of base wordt toegevoegd?  Wat zijn enkele van de principesoplossing die verkoopt?
Wat zijn enkele van de principesoplossing die verkoopt?  Bijen en vlinders gaan achteruit in westelijk en zuidelijk Noord-Amerika
Bijen en vlinders gaan achteruit in westelijk en zuidelijk Noord-Amerika  Als een bruine dwerg de maan raakt?
Als een bruine dwerg de maan raakt?  Reusachtige magnon-spingolfgeleiding in ultradunne isolatoren verrast onderzoekers
Reusachtige magnon-spingolfgeleiding in ultradunne isolatoren verrast onderzoekers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

